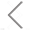为什么癌症早期诊断离不开单EV分析?
Author: Mika Huang Date: December 1, 2022
癌症早期诊断的目标是在1 mL血液中检测出小于1 mm3的肿瘤。目前单个EV分析技术已经应用于多种癌症的诊断,包括结直肠癌、鼻咽癌、前列腺癌、乳腺癌、宫颈癌、黑色素瘤以及胰腺导管腺癌等。
INTRODUCTION
某个患者的癌症会持续发展直至转移吗?这是基础保健、肿瘤学、预防医学、流行病学以及医疗保健系统持续关注的问题。这一问题需要具有高度灵敏和特异性的同时且低成本的“液体活检”技术来解决。肿瘤在其生长过程中释放到循环系统中的多种成分就成为了解决这一问题的突破口,其主要包括循环肿瘤细胞及其团簇、ctDNA、EVs、蛋白质等。
癌症早期诊断的关键问题是:哪种血液成分最适合检测;某一个标志物的含量(罕见或超罕见);对于特定的癌症,包括癌症发生的位置,这个标志物有多独特?
1.为什么是EV而不是CTC或者ctDNA
EVs的优势首先在于其含量丰富,肿瘤细胞在生长过程中可持续不断地分泌EVs并进入循环系统,且因其代谢速率高导致EV的产量也远高于正常细胞。此外,相比于ctDNA的生成依赖于肿瘤细胞的死亡,EVs由活细胞所产生,它的产生更像是一个持续发生的事件,可以实时反映肿瘤发展的进程。例如,在晚期黑色素瘤中,含有突变等位基因BRAFV600E和cKITD816V的DNA更多与EVs之间并无相关性,但并不能据此判断为早期黑色素瘤;而另一项研究发现了exoDNA和ctDNA之间具有很好的相关性,但exoDNA的KRAS突变的存在与新辅助治疗后的疾病进展紧密相关。此外,EVs的磷脂双层膜结构可有效保护其所运载的RNA和蛋白质,避免其在循环系统中的降解,使得RNA和蛋白可被用于肿瘤的“液体活检”。
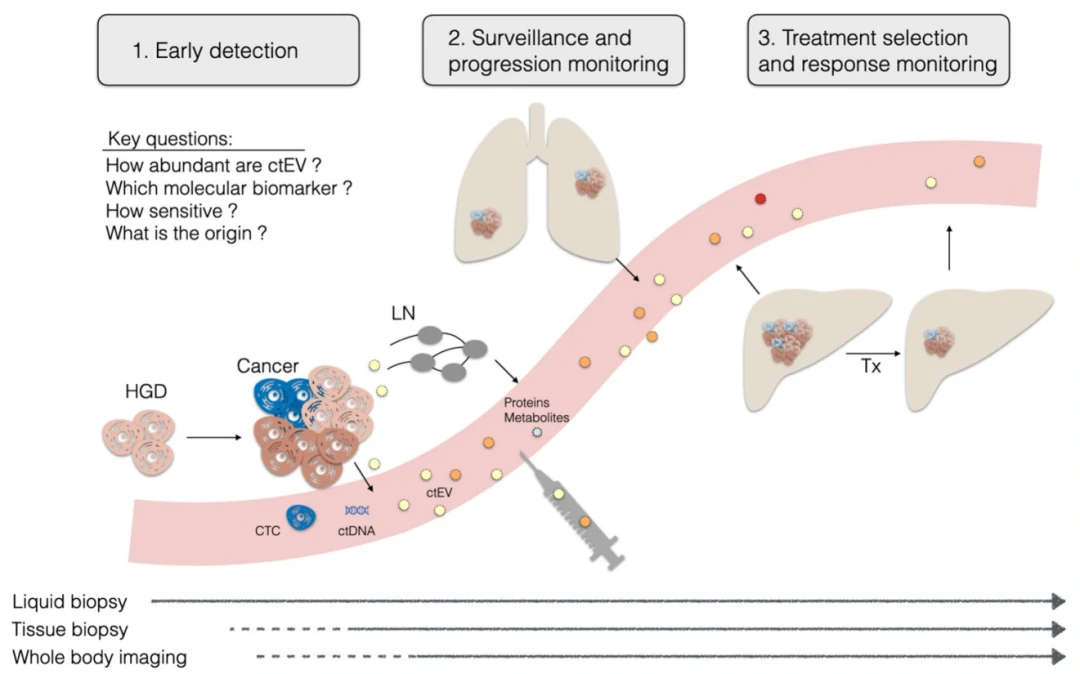
图1. 液体活检在癌症分析中的作用
2.为什么要进行单EV分析?
现有的文献模型通常认为外泌体以及其它EVs包含有大量的蛋白质和核酸。这些观点大多数基于不考虑异质性的前提下,对一群EVs选用的集权平均的分析方法获得的结果。随着EV研究的深入,科学家发现单个EVs上的蛋白质和核酸远没有那么丰富,只有很小一部分EVs含有肿瘤特异的标志物,如突变的蛋白质等(图2)。那如何在循环系统这一EVs的汪洋中检测出这部分高度特异但是稀有的ctEVs?此外,高度的异质性是EVs的主要特征之一,即使来源于同一个细胞的EVs之间也是千差万别,且肿瘤群体中的细胞本就具有极大的多样性。基于以上因素,EVs的单颗粒水平分析就成为了基于EVs的“液体活检”的必经之路。
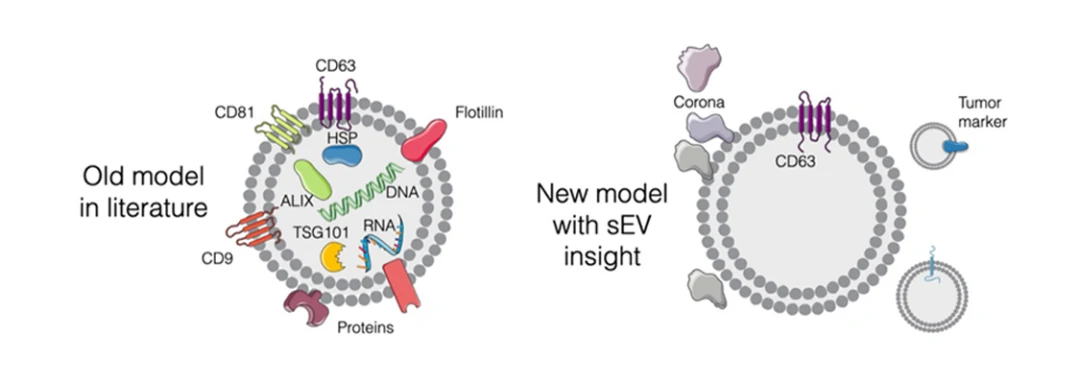
图2. EV的组成
单个EV分析技术的优势之一就是能够揭示EVs的异质性,并将EV蛋白、核酸组成与亲代细胞的组成进行比较。在单个EVs水平,蛋白标志物的含量比mRNA以及DNA生物标志物的含量高很多,且这些肿瘤相关标志蛋白可被抗体简单有效识别。最近,来自麻省总院的Weissleder教授团队发现即使几乎所有的ASPC1细胞(人转移胰腺癌细胞系)均表现为KRASmut,P53mut或者其他生物标志物(MUC1,EGFR或FG-P4OH等)阳性,但其所产生的EVs也仅有40%表现出KRASG12D阳性或P53mut阳性。类似的现象在其它胰腺癌细胞系中也均有发现,即从细胞上清中收获的EVs中大约40-50%没有相关肿瘤标志物的表达。
人血液中的ctEV被其他细胞衍生的EVs进一步稀释了,那血液中ctEV的丰度和异质性如何呢?有模型计算得出,人体内的肿瘤每增大1 mm3,每毫升血液中相应地会增加23-1900个ctEVs。即使是分泌速度最慢的肿瘤细胞,其所释放EVs的速度也比非肿瘤细胞高至少一个数量级。这个结果与很多文献报道的发现吻合,在晚期肿瘤患者体内,均发现循环囊泡的数量成倍增加。因此,一种灵敏的检测方法,如果能在1 mL血液中检测出小于1 mm3的肿瘤,将有望把癌症早期检测和监控提前几年甚至十几年。可惜目前绝大多数的分析技术远远达不到这么高的灵敏度。由于非特异性的背景信号占据主导和并非所有的ctEVs的癌症特异标志物都是阳性的这两大原因,传统的集权平均的方法,如WB和ELISA等,能够测到小于1 cm3的肿瘤的概率微乎其微。而新型单囊泡分析技术在这一领域则被寄予厚望。
3.单个EV分析技术
针对EVs的集权平均分析方法的相关综述屡见不鲜,而利用EVs真正实现癌症早期诊断的报导则屈指可数。近5年才开始陆续出现能够实现单个EV的表型分析的方法,其中大多数方法利用荧光传感,光散射或者电子吸收等原理。典型的研究型方法包括透射电镜,冷冻电镜,原子力显微镜,超分辨荧光显微镜,全内反射荧光显微镜,拉曼光谱等,而这些方法往往伴随着需要比较多的操作时间、贵重的仪器设备以及专业的操作技能,通量低等局限性。
经过多年的持续发展,在临床环境中实现单EV分析并且具有诊断前景的技术已经出现,主要围绕分离或者传感等需求。这些方法在准确度、复杂程度、诊断时长以及每个样品的花费方面均有差异。其中,无偏见单EV分析已经成功应用于几种癌症类型的诊断,包括结直肠癌、前列腺癌、乳腺癌、宫颈癌、黑色素瘤以及胰腺导管腺癌(PDAC)等。
需要特别指出的是,纳米流式检测技术(NanoFCM)是一个备受关注并被寄予厚望的技术领域,有可能实现快速高通量、自动化和规模化。
早在2018年,就有学者利用纳米流式检测技术在单EV水平实现了结直肠癌的早期诊断。今年厦门大学的科研团队基于EVs发展了鼻咽癌的早期诊断方法,AUC可达1.000,该方法同时可实现鼻咽癌和鼻咽炎的区分。(厦大团队揭秘如何通过EVs区分癌症和炎症)
4.如何分离纯化EVs?
从复杂的体液环境中获得高纯度的EVs,一直是EV研究和临床应用中亟需突破的重要瓶颈。目前市面上的EV分离方法,所需的时间和获得EV的纯度都有差异。务实地说,方法的选择取决于要解决的是临床前还是临床的问题。超速离心(密度梯度离心)是EV分离最经典的方法,但耗时长和回收率低是一直被诟病的问题。一些更快速的方法,如聚合物沉淀、免疫捕获以及超滤、尺寸排阻色谱等也可以提供EV分离的方案,它们各自有独特的优势和局限性。
不管选用什么分离纯化方法,都需要进行严格的质量控制确保EV的富集效率和纯度,检测一些指标:合理的尺寸和电性;可控的凋亡小体、脂蛋白或者其他蛋白团聚体的干扰。
在早期的推文中,小编详细介绍过血浆来源EVs的常见分离纯化方法对比(做外泌体,我的纯化方法靠谱吗?如何质控?)以及不同来源的EVs的分离纯化方法的比较分析(外泌体分离纯化方法——适合自己的才是最好的!),感兴趣的小伙伴们可以回顾一下。
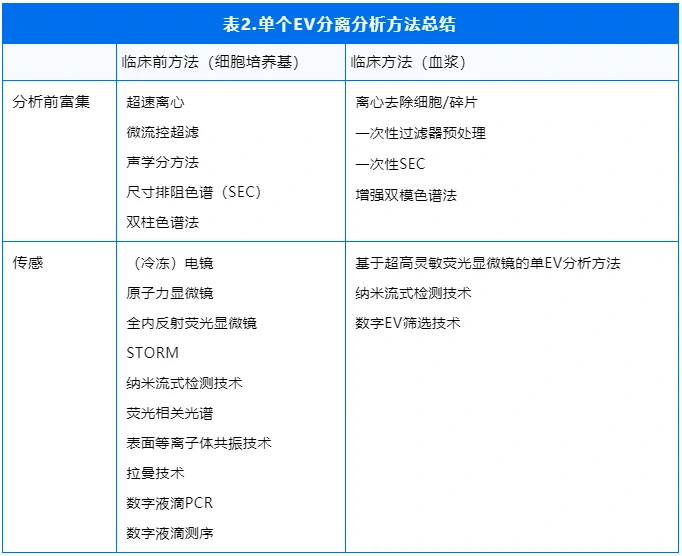
5.EV进入临床诊断的难点?
目前基于EV的发现研究绝大多数基于集权平均的分析方法,且鲜有验证研究的报道。一种方法能否进入临床,有一些先决条件:
(1)处理小体积血浆的能力
(2)速度快且高通量
(3)自动化和规模化
(4)重现性
(5)合理的花费
单EV分析中的大多数技术挑战已经被攻克,但仍然存在一些重要挑战。这其中包括需要更深层次的分析手段来:
(i)鉴别良性和恶性EVs
(ii)确定循环肿瘤衍生的EVs(ctEVs)的器官来源
(iii)更好的理解不同癌症中EVs的异质性
(iv)发现新的有潜力的EV生物标志物
缺乏严格、控制良好的临床研究是其中一个尤为重大的挑战。
早期诊断对于肿瘤的干预和治疗的重要性是毋庸置疑的。单个EV的分析将探索和阐明循环EVs带入到一个令人兴奋的新研究领域,希望其作为新兴的临床分析方法可以用于各种不同恶性肿瘤的早期筛查。
参考文献
·Scott Ferguson et al. Single extracellular vesicle analysis for early cancer detection [J]. Trends in Molecular Medicine, 2022; 28, 681-692.
·Scott Ferguson et al. Single-EV analysis (sEVA) of mutated proteins allows detection of stage 1 pancreatic cancer [J].Science Advances, 2022; 8eabm3453.
·Ye Tian et al. Protein Profiling and sizing of extracellular vesicles from colorectal cancer patients via flow cytometry [J]. ACS Nano, 2018; 12: 671-680.
·Huilin Shao et al. New technologies for analysis of extracellular vesicles [J]. Chemical Review, 2018; 118: 1917-1950.
·Liang Dong et al. Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium [J]. Journal of Extracellular Vesicles, 2020; 10:e12044.
·Ye Tian et al. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry [J]. Journal of Extracellular Vesicles, 2020; 9:1697028.
·Yunyun Hu et al. Noninvasive Diagnosis of Nasopharyngeal Carcinoma Based on Phenotypic Profiling of Viral and Tumor Markers on Plasma Extracellular Vesicles [J]. Analytical Chemistry, 2022, 94, 24, 9740-9749.