外泌体分离纯化方法:选择适合自己的!
Author: Mika Huang Date: October 12, 2021
背景介绍
细胞外囊泡(Extracellular vesicles, EVs)具有多种生物学功能,可参与机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等,在多种疾病和生理过程中扮演重要的角色。由于EVs的来源、分离纯化方法等存在差异,导致研究结果间的重复性和一致性不佳。造成这种结果的原因之一是:研究者使用不同的分离方法纯化EVs,不同分离纯化方法获得的EVs具有不同水平的污染物,导致结果存在差异。故亟需对不同来源的EVs的不同分离纯化方法进行比较分析,监测EVs的纯度和污染物水平,制定统一的EVs分离纯化和表征标准。

在往期的推文中,小编分别介绍过厦门大学颜晓梅教授团队“做外泌体,我的纯化方法靠谱吗?如何质控?”和暨南大学王通教授团队“前景诱人:外泌体分离方法新突破”关于EVs纯化方法的工作,从科学研究的角度评估外泌体的纯度、回收率等各项指标。今天小编想介绍另一篇同样发表在Journal of Extracellular Vesicle上的文章,题为“Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium”,来自约翰霍普金斯大学医学院和上海交通大学附属仁济医院的专家们以临床需求作为切入点,对临床样本中EVs的分离方法进行综合、客观的比较。
文章选取血浆、细胞上清、尿液三种典型样本作为EVs的来源,对比超离(UC)、沉淀(Precipitation)、尺寸排阻加超滤(SEC+UF)、微流控(Exodisc)等纯化方法,综合评估它们的纯化效果,然后基于样本类型和下游应用,对分离纯化方法的选择提出了切实可行的建议。
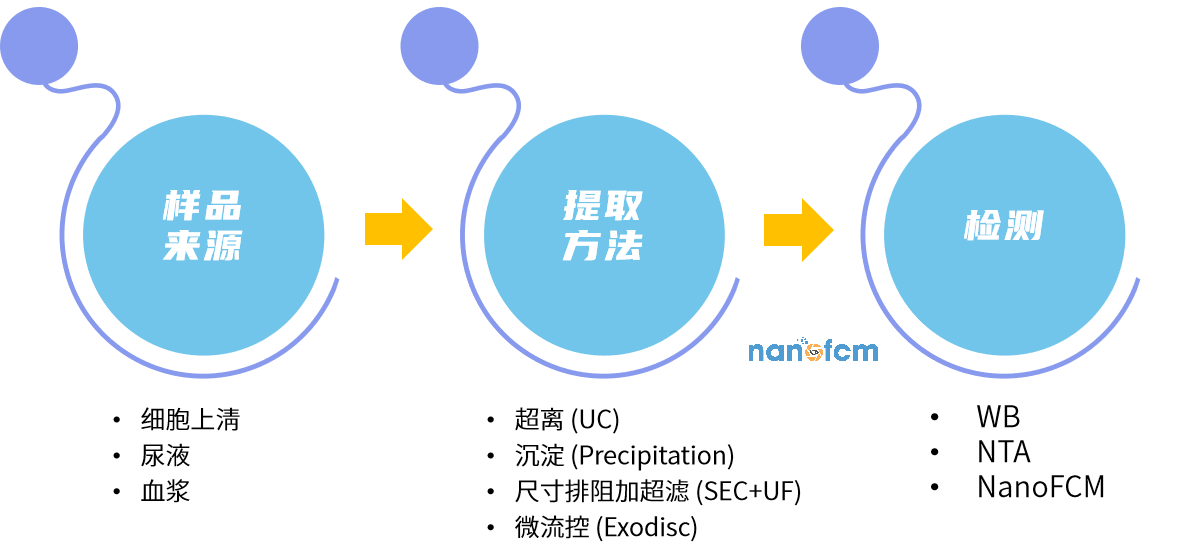
研究思路
A.产率分析
首先通过几种方法对细胞上清、尿液、血浆来源的EVs进行分离提取,统计EVs的颗粒浓度。NanoFCM(纳米流式)的结果显示,在细胞上清样本中Precipitation方法具有较高的产率;而在尿液中Exodisc产率较高;对于血浆样本而言除UC外,几种方法的产率大致相同(图1)。值得指出的是颗粒数的多少,并不能真实反映EVs的回收效率,因为这些颗粒中可能包含杂质颗粒,需要进一步对EVs进行纯度分析。
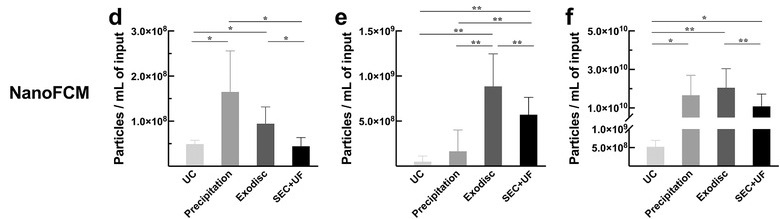
图1.不同纯化方法获得的EVs颗粒浓度
B.纯度分析
颗粒蛋白比:颗粒数和蛋白浓度的比值是评估EVs纯度的方法之一,作者测定了不同来源和纯化方法得到的EVs颗粒数和蛋白浓度,每微克蛋白中的颗粒数越多,说明EVs纯度越高。结果显示血浆来源的EVs蛋白和颗粒浓度都很高,表明血浆当中可能存在大量蛋白颗粒污染(图2)。而颗粒蛋白比显示,在细胞上清中,UC和SEC+UF得到的EVs纯度较高;在尿液中,SEC+UF和Exodisc法得到的EVs纯度较高,Precipitation法得到的EVs纯度较低;在血浆当中,颗粒蛋白比整体较低,只有SEC+UF法获得的EVs纯度较高(图2)。表明不同纯化方法适用于不同来源的样本,SEC+UF在几种样本中均有不错的表现。
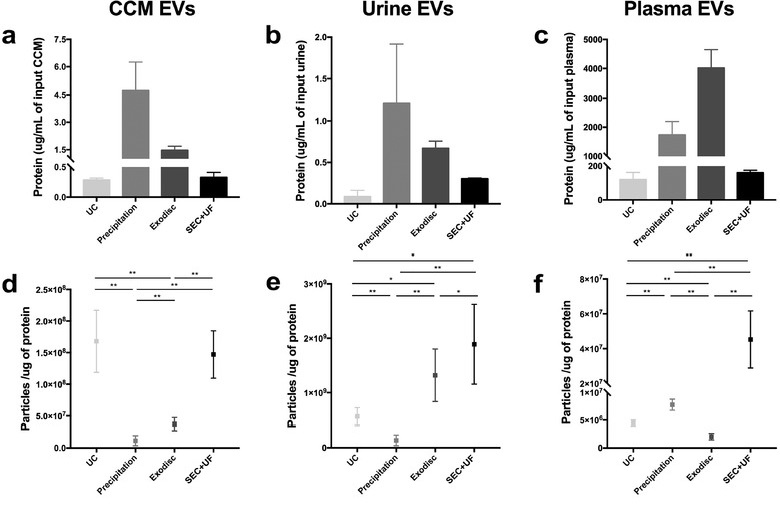
图2.NanoFCM测定EVs的蛋白颗粒比
密度梯度离心:为了进一步验证不同方法获得的EVs纯度,作者将不同方法纯化得到的EVs进行密度梯度离心,测定不同密度条带中EVs的颗粒纯度。首先通过WB和TEM确定了密度梯度梯度离心的EVs条带在密度为1.10-1.15 g/mL范围(图3)。
通过测定3个不同条带之间的颗粒数比值可以准确计算出EVs的纯度(图3),NanoFCM结果显示在细胞上清中,各种方法获得的EVs纯度均超过60%,而Precipitation和Exodisc法的EVs条带颗粒浓度明显高于另外两种纯化方法(图3),说明对于细胞上清不同方法均可获得较高纯度和产率的EVs;对于尿液样品,EVs纯度略低于细胞上清,不同方法之得到的纯度差异并不显著,但Exodisc和SEC+UF法的EVs条带颗粒浓度较高;而对于血浆来源的样品,SEC+UF法可获得更高纯度的EVs,UC次之,Precipitation和Exodisc法纯度较低(图3);另外值得指出的是,血浆样本的总体颗粒浓度(1E8-1E9 particles/mL)比细胞上清或尿液(1E7-1E8 particles/mL)高出一个数量级,可能由于血浆当中有很多的杂质颗粒。不同的纯化方法对EVs的纯度影响很大,对于血浆样品更需要关注的是EVs的纯度而不是产率。表1分别统计了几种纯化方法得到的EVs的纯度,供读者参考。
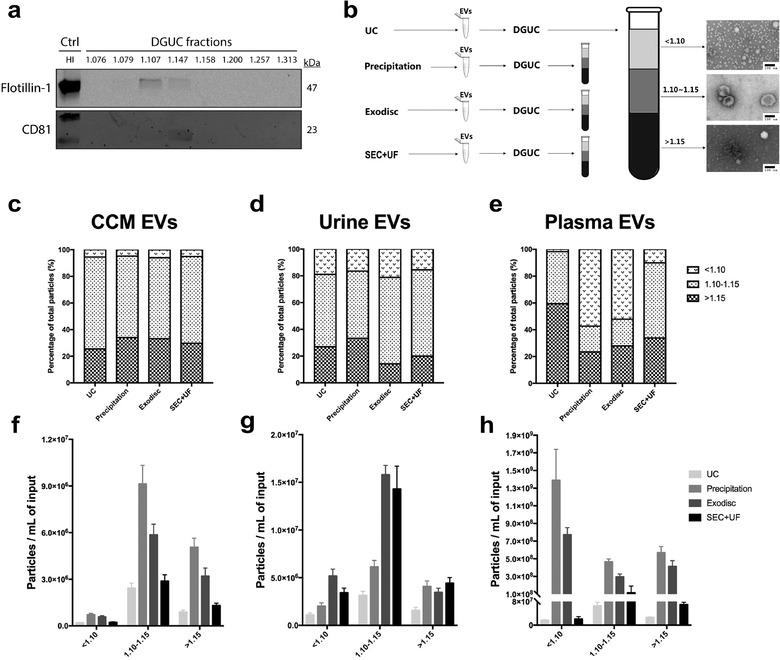
图3.密度梯度离心测定EVs纯度
表1.不同纯化方法获得的EVs纯度测定

说明:“+”表示纯度,+++ > ++ > + ; DGUC: Density gradient ultracentrifugation;不同来源的EVs纯度间对比仅供参考。
C.表面标志物分析
作者另外还对比了这些方法获得的EVs传统标志物CD9、CD63、CD81的表达情况。细胞上清(CCM)来源的EVs中,三种蛋白的表达比例均在30%左右;尿液提取的EVs中CD9的表达比例较高,CD63和CD81的比例较低;而在血浆中,这些蛋白标志物的表达比例均在5%左右。
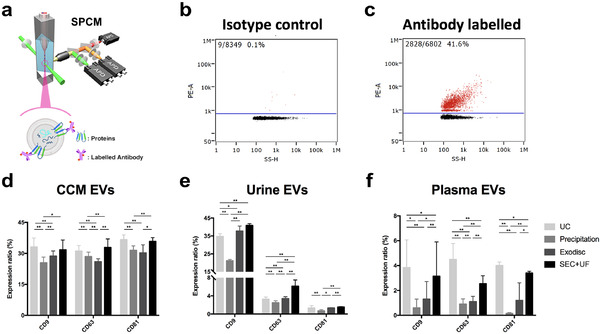
图4.NanoFCM测定EVs表面标志物
结论
作者对不同来源的EVs的不同纯化方法进行了对比,发现Exodisc和Precipitation具有较高的EVs产率,可能更适用于杂质较少的细胞上清或尿液样本;UC方法获得的纯度较高,但是产率较低;在不同来源的样品中,SEC+UF均可获得较高纯度和产率的EVs。研究者需要综合考虑样品的来源、下游实验需求、成本、时间等因素,选择合适的EVs纯化方法,在产率和纯度之间找到平衡。同时根据不同样品类型和实验需求给出了具体建议(图5),供后来者参考。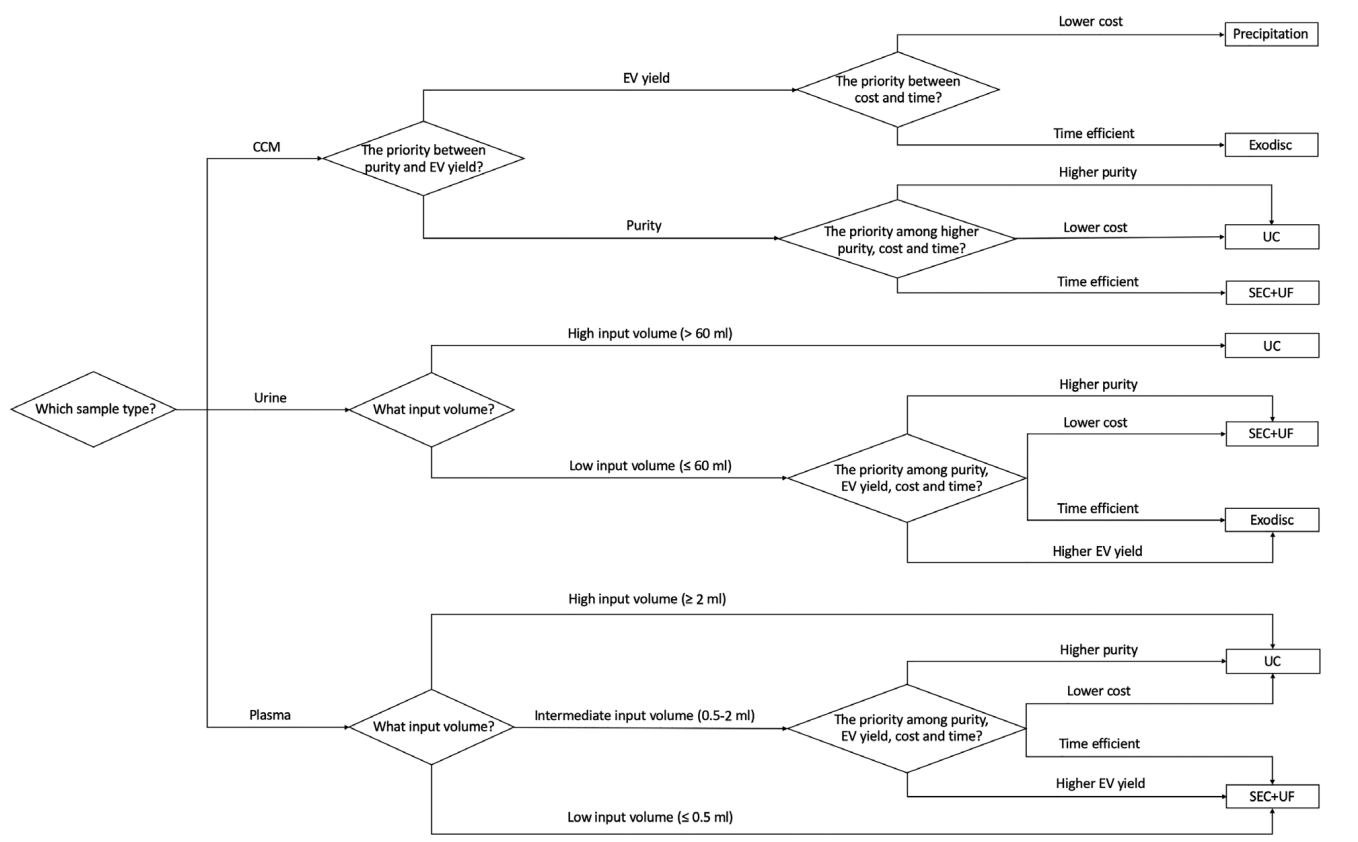
图5.EVs纯化方法选择
展望
EVs是目前炙手可热的研究内容,特别是在疾病诊断和治疗等领域,但是目前并没有统一的EVs纯化流程和质控标准。全球的研究者纷纷投身EVs纯化流程相关研究,NanoFCM可在单颗粒水平对EVs的大小、浓度、纯度、蛋白、核酸等多种参数进行表征,评估不同纯化方法,优化纯化流程,助力EVs的研究,相信在不久的将来EVs纯化的标准流程和质控标准里一定能看到NanoFCM的身影!
本期有彩蛋~早期大家关注的还只是少量/小体积样品的分离纯化,经过多年的发展,目前外泌体领域已经从纯粹的科学研究转向了产业化,那么工业生产中如何实现样品的大规模分离纯化处理呢?欢迎关注我们,咱们下期再叙。
参考文献:
- Dong, Liang, et al. “Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium.” Journal of extracellular vesicles2 (2020): e12044.
- Jiahui,Guo, et al. ” Establishment of a simplified dichotomic size-exclusion chromatography for isolating extracellular vesicles toward clinical applications” Journal of extracellular vesicles 2021;10:e12145.
- Tian, Ye, et al. “Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry.” Journal of extracellular vesicles1 (2020): 1697028.