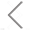干细胞 外泌体:未来已来,你来不来?
Author: Mika Huang Date: September 3, 2021
在上一篇推文《细胞外囊泡——下一代药物递送平台》中,小编介绍了细胞外囊泡在药物递送领域的优势及挑战。今天,小编将介绍外泌体,主要是干细胞外泌体在组织修复和再生中的应用潜能及挑战。
作为全球的焦点和热点,干细胞是生命科学的前沿,也是治疗重大的难治性疾病的新的技术手段,且干细胞移植被认为是再生医学中很有潜力的方法之一,目前全球已经有十几款干细胞产品获批上市。近期,国际干细胞研究学会(ISSCR)发布了2021年更新版《干细胞研究和临床转化指南》,把干细胞的临床转化标准化推向了新的高度。国内方面,虽然尚无上市的干细胞治疗产品,“干细胞研究与器官修复”已列入“十四五”国家重点研发计划,国内干细胞领域的标准也在逐步发展和不断完善中。2021年3月,中国细胞生物学会标准工作委员会发布了6项干细胞领域团体标准,国内干细胞相关的临床研究的备案审核有了更清晰的依据。
同时我们也清醒地意识到,由于干细胞存在致瘤性、促炎症和宿主排斥等风险,狭义的干细胞治疗的安全性仍然是临床上面临的挑战。目前,有大量研究证明,干细胞来源的外泌体中含有干细胞的生物活性物质,能够替代干细胞发挥器官及组织损伤修复等重要的生物学功能。尽管长期以来被忽略,但干细胞外泌体的应用在干细胞移植中避免了多种潜在风险,且外泌体具有先天无免疫原性、便于保存和运输等特点,作为“无细胞的干细胞治疗技术”显示出得天独厚的优势,所以许多传统的干细胞治疗开发者们开始转向干细胞外泌体这一“副产物”来寻求更好的解决方案。除了国家在基金层面的大力支持,干细胞外泌体领域也吸引了越来越多的产业化基金,许多致力于干细胞治疗的知名公司和制药巨头都瞄准了外泌体这一黄金赛场,纷纷增加外泌体相关的管线,推动该领域的飞速发展。
细胞外囊泡 (EVs) 是一类包载了核酸、蛋白质、脂类等生物活性分子的膜性囊泡,其内含物在一定程度上类似于其来源母细胞,是细胞间信号传输的载体。根据分泌途径的不同,EVs 主要分为外泌体和微囊泡两大类,由于国内读者习惯称呼“外泌体”,故文中不对 EVs 与外泌体做明显区分。有研究表明,细胞外囊泡的蛋白质和 RNA,可介导靶向细胞间的信号传递,甚至遗传信息的功能性转移,这一发现极大地促进了细胞外囊泡在再生医学领域的发展。
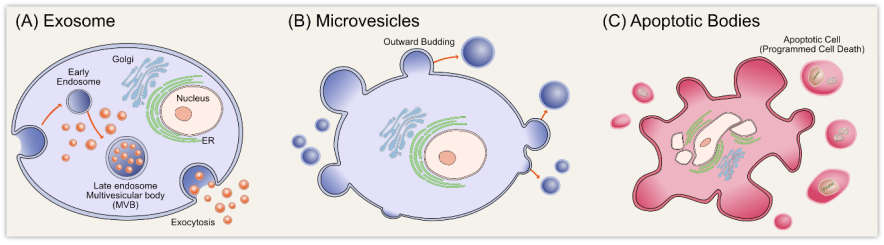 图1. 细胞外囊泡示意图
图1. 细胞外囊泡示意图
一、EVs作为再生制剂的潜能
EVs 包含着多种生物大分子如蛋白质、脂质和核酸等,其携带的内含物在一定程度上类似于其来源母细胞。EVs 本质是异质性群体,大小不均一,成分复杂,不同组织和细胞之间的活性分子可能会有所不同。几乎所有的细胞都会分泌 EVs,其中间充质干细胞(MSC)由于其旁分泌机制发挥治疗作用成为再生应用中流行的 EVs 细胞源。尽管 MCS 分泌的外泌体是研究中常见的类型,但也存在其他细胞来源如胚胎诱导的多能干细胞,组织特异性干细胞以及初级前体和成熟细胞等分泌的外泌体成功应用于再生治疗中。由于 EVs 具有良好的生物相容性以及低免疫原性等优点,EVs 作为潜在的治疗制剂在组织修复和再生中获得了广泛的关注,越来越多的研究评估了它们对各种器官和组织修复和再生的适用性。
1.EVs具有再生潜力
细胞外囊泡作为天然的大分子载体,其再生潜力主要归因于对免疫调节、细胞迁移、分化、血管生成和组织极性的调节。有多项研究研究表明,EVs 主要通过其携带的生物分子在不同组织和器官中诱导再生和治疗效果。天然的 EVs 携带的表面的膜蛋白或负载蛋白和核酸分子如 mRNA、miRNA等可在结合和细胞内化后激活靶细胞的信号转导,调节靶细胞的迁移能力、耐药能力等。如来源于间充质干细胞(Mesenchymal Stem Cell, MSC)的 EVs 通过传递 miRNAs 可减少角膜纤维化和炎症;对MSC-EVs 蛋白质组的研究表明,它们含有可以介导血管生成、凝血、细胞凋亡、炎症以及组织再生的蛋白质。因此,EVs 携带的内含物在再生医学上具有巨大的应用潜能。
2.干细胞EVs工程化改造
细胞外囊泡作为药物递送的载体,有着适应生理环境的优势。然而天然 EVs 可携带的药物种类和数量有限,这给 EVs 在再生治疗的应用带来了挑战。目前,通过现有的基因工程技术和手段如共孵育、转染、电穿孔、超声处理和原位合成等各种策略实现 EVs 的改造。通过对 EVs 包裹的核酸或膜表面蛋白进行重组、改造、修饰或更新,可以给 EVs 赋予新的功能和作用。
(1)利用干细胞 EVs 作为载体递送药物用于疾病治疗是目前较为常见的研究类型。上海第六人民医院 Zhu 等尝试在胚胎干细胞来源的外泌体内加载紫杉醇(paclitaxel, PTX)用于恶性脑胶质瘤的治疗并取得一定的成功。研究中对胚胎干细胞外泌体粒径、活性、以及药物的装载效率等物理生化性质的进行分析。发现,胚胎干细胞来源的外泌体对胶质瘤细胞具有抑制作用。并且通过工程化手段对外泌体进行修饰(修饰 cRGDyK 肽段)使其能够靶向肿瘤组织,通过纳米流式检测仪直观的观察到修饰前后外泌体的粒径变化。同时在外泌体内部装载紫杉醇药物后,可提高外泌体抗胶质瘤的能力,为治疗恶性胶质瘤和其他类型肿瘤疾病的研究提供新的思路。下图是借助纳米流式检测仪 (NanoFCM) 发表的部分研究结果。

图2. 胚胎干细胞外泌体粒径分布、ESC-EXO活性结果、凋亡情况
(2)牛奶来源的 EVs 比干细胞来源 EVs 更易获取且成本更低,应用广泛。如 Chen 等以乳源性 EVs(mEVs) 为模型,基于细胞外囊泡表面修饰,开发了一种通用且温和的表面功能化方法,证明可以在不破坏 mEVs 结构的前提下,将多种配体固定在其表面。利用 NanoFCM 单颗粒检测的优势,揭示了纯化前后的偶联效率以及改性 mEV 的异质性。此外,细胞摄取和细胞毒性实验表明结合配体的 mEVs 细胞靶向性和货物输送能力显著提高,体内成像实验进一步证明了转铁蛋白偶联技术在提高mEVs 肿瘤区域富集能力的适用性。总的来说,这种修饰方法能够实现食品源性细胞外囊泡 (FDEVs) 表面的有效功能化,将有望加速基于 EVs 表面修饰的疗法的发展。
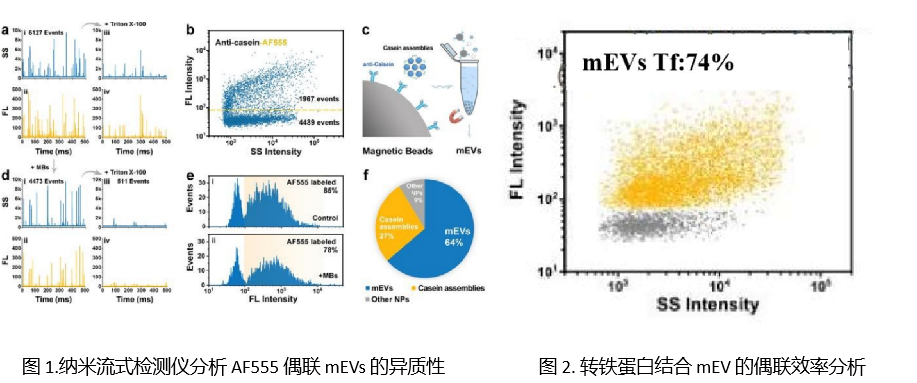
图3. mEVs异质性及转铁蛋白结合mEVs的偶联效率分析
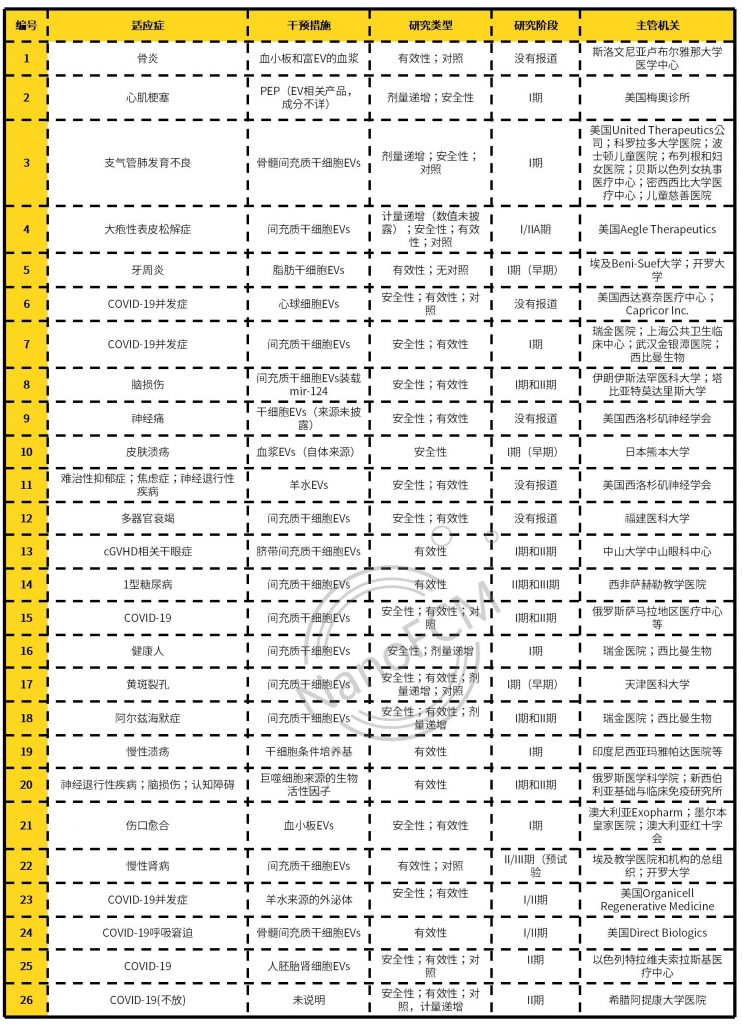
EVs 作为药物载体,可高效向特异损伤的组织器官递送治疗物质,为组织器官再生治疗提供了新思路,目前已经累积了许多成功的案例。表1对不同器官系统中 EVs 的治疗案例进行了总结。这些案例证实不管是天然的 EVs 还是经过工程化改造的EVs 在再生医学领域均能带来更多、更大的惊喜。
表1.目前针对不同系统的EVs再生治疗案例
二、EVs在体内分布、安全性及表征技术挑战
有研究认为 EVs 在体内的生物分布取决于其来源母细胞,EVs表面的分子组成、给药途径等亦可显著影响其生物分布。例如,小鼠体内静脉注射后优先在肝脏、脾脏、胃肠(GI)道和肺中积累,树突状细胞分泌的 EVs 优先被脾脏吸收,而间充质干细胞来源的 EVs 在肝脏和脾脏中积聚。目前脂质纳米粒子在体内和体外递送的有效性和生物相容性已得到广泛的关注。与脂质纳米粒子相比,EVs 作为药物的载体具有更大载药能力、调节和靶向特定的组织以及安全性和药代动力学等方面的优势。截至目前,鲜有关于 EVs 给药后副作用的报道,因此,可以认为干细胞 EVs 给药基本安全。同时,由于 EVs 的大小不均一、成分复杂,在 EVs 的综合表征和质量保证方面存在局限性,限制了 EVs 临床转化的进程。
目前,利用集权平均的方法分析 EVs,可确定大量的 EVs 内含有不同的生物分子。但是 EVs 尺寸微小,异质性大,单个 EVs中携带的载物数量存在一定的限制,且不同来源的 EVs 含量也存在显著差异。细胞外囊泡作为再生制剂,若其中包含过多非功能性成分很可能会降低其治疗效果,且治疗时常需要使用更高剂量。因此,对囊泡生物分子基于单颗粒水平的分析将比利用集权平均的表征更有助于判断 EVs 作为治疗制剂的疗效。并且基于单颗粒水平的分析技术更有望促进 EVs 亚群以及具有生物活性的 EVs 亚群的识别和表征。
三、EVs再生疗法的临床应用与产业化发展
目前,全球范围内的临床试验数据库中注册了数十项涉及 EVs的研究,但大多数旨在监测循环 EVs 作为疾病的生物标志物、疾病进展和应用治疗的有效性。表2总结了 EVs 用于组织再生修复的案例,临床试验多处于I期或II期,目的是为了评估用于治疗的 EVs 的安全性和有效性。而 COVID-19 的大流行推进了多项MSC 衍生的 EVs 临床试验的启动,旨在减轻患者在感染 SARS-CoV-2 病毒后的并发症。这些试验的结果无疑将有助于进一步了解 EVs 在免疫调节中的临床价值。同时,也有不少公司积极投入到EVs的治疗产品的开发中,其中 Capricor Therapeutics、Aegle Therapeutics、United Therapeutics和Exopharm等公司利用 EVs 作为组织修复的生物治疗制剂进行临床试验,余下的大部分公司预计未来几年将会陆续进行人体研究。此外,利用细胞外囊泡的再生特性生产的产品在化妆品和护肤领域的应用中也受到了持续且广泛的关注。
由于 EVs 疗法的创新性,其临床分级、生产质控以及在应用上缺乏世界公认的标准。因此,EVs 产业化发展还需克服以下几个方面的限制:
(1)建立适用于临床大规模制备、纯化和储存的分离方案;
(2)EV的量化、分子和物理表征的标准化方法;
(3)明确临床使用的质量控制标准等。
表2. 临床中应用于组织修复和再生的EVs制剂
四、总结与展望
细胞 EVs 作为一种崭新的治疗方法具有在组织损伤修复及再生的应用及其他疾病治疗的治疗潜力。体内和体外研究认为,EVs 通过促进细胞增殖、分化和血管生成以及抑制细胞凋亡和炎症来介导组织修复。但是由于缺乏有效的表征技术以及标准化的分离方法,EVs 是如何促进组织再生以及是什么驱动它们再生作用的机制仍远未阐明。此外,由于其复杂的药代动力学,需要进一步的去探索其作为治疗制剂在再生效应中发挥作用的机理。因此,在单颗粒水平对 EVs 进行表征分析,并剖析不同EVs亚群的特定内含物,及其特定的生物学作用,将有助于更好地定义用于组织修复和再生的 EVs 制剂的作用机制。
作为一款“为外泌体为生”的检测设备,纳米流式检测仪(NanoFCM)可在单颗粒水平对 40-1000 nm 的 EVs 进行单颗粒分析,具有与电镜结果相媲美的分辨率。NanoFCM 还是一款省时,省样品又省力的检测仪器。对于样品的实际消耗只需0.1 μL ,1min即可实现样品检测,一步检出粒径分布、颗粒浓度以及阳性表达率等。
总的来说,不仅可对 EVs 的颗粒浓度、粒径分布、载药量、蛋白、核酸等物理生化性质进行分析,还对 EVs 的生产过程进行质量控制,优化生产条件、提高载药效率。同时可对 EVs 在生产后的稳定性进行评价,评估不同存储条件对 EVs 的影响。NanoFCM 的应用贯穿整个 EVs 制剂研发、大规模生产、分离纯化、质控、稳定性评估等整个过程,极大加速 EVs 产品研发和产业化进程!
参考文献:
- An A , Mo B , Lvdk C , et al. Extracellular vesicles for tissue repair and regeneration: evidence, challenges and opportunities[J].Advanced Drug Delivery Reviews, 2021.
- Gurunathan S, Kang MH, Jeyaraj M, Qasim M, Kim JH. Correction: Gurunathan, S. et al. Review of the Isolation, Characterization, Biological Function, and Multifarious Therapeutic Approaches of Exosomes[J]. Cells2019, 8, 307. Cells. 2021.
- Zhu Q , X Ling, Yang Y , et al. Embryonic Stem Cells‐Derived Exosomes Endowed with Targeting Properties as Chemotherapeutics Delivery Vehicles for Glioblastoma Therapy[J]. Advanced Science, 2019.
- Chen C , Sun M , Liu X , et al. General and Mild Modification of Food-derived Extracellular Vesicles for Enhanced Cell Targeting[J]. Nanoscale, 2021.
- 王前,郑磊《细胞外囊泡—基础研究与临床应用》[M].科学出版社.2019.