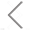最新突破:如何从体液中获得真正的细胞外囊泡
Author: Mika Huang Date: January 31, 2023
由于细胞外囊泡(extracellular vesicles, EVs)在疾病诊断以及治疗领域的巨大潜力,被视为液体活检和药物递送的明日之星。围绕这些小囊泡的基础研究持续升温,在工业界亦是炙手可热。但是,EVs的来源环境往往极其复杂,如细胞培养上清、血液、尿液以及腹水等生物体液,其自身在粒径、组成成分等方面与杂质颗粒存在重叠,如何从复杂环境中纯化得到高质量的EV样本,一直是该领域面临的重要挑战。
目前在血浆等体液来源外泌体的研究中,差速离心结合密度梯度离心的方法是当前最广泛使用的高纯度外泌体分离方法。但该方法耗时长、操作繁琐、难以平衡颗粒得率和产物质量且过高的离心力不可避免地对EV的完整性和组成成分造成不同程度的影响。因此,这些因素限制了该方法向临床应用和工业界的转化。
近日,来自德国马尔堡大学肿瘤免疫研究中心的Strandmann教授团队及合作者们在《J Extracellular Bio》上发表了题为“Isolation of native EVs from primary biofluids—Free-flow electrophoresis as a novel approach to purify ascites-derived EVs”的研究型文章,开发了一种从复杂的生物体液样本中高效分离纯化EVs的新方法。

由于磷脂双层膜结构和表面高丰度的糖基化蛋白,EVs的表面电势通常表现为负电势(zeta电位),而脂蛋白及蛋白团聚体等杂质颗粒主要表现为正电势。基于EV与杂质颗粒的固有电荷密度或等电点的差异,作者利用自由流动电泳技术(free-flow electrophoresis, FFE),并通过优化分离纯化缓冲液的pH值、分离介质、电导率和电压等条件,开创性地发展了一种从富含蛋白颗粒及其他生物大分子的生物体液(如腹水)中高效纯化EVs的方法。该方法具有分离通量高和速度快等优点,在6小时内即可完成100个样本的分离纯化,有望用于临床样本中EVs的分离,加速EVs的临床应用转化。
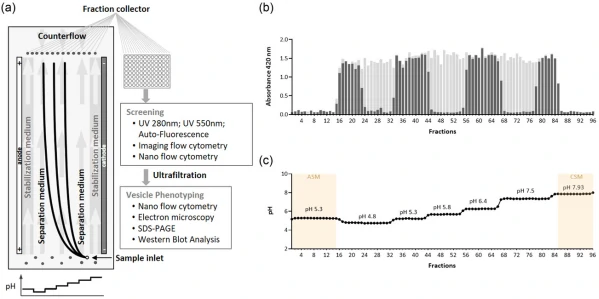
图1. FFE设备原理概述及工作流程
如图1所示,加载到样品入口的预分离样本通过纵向流运输在垂直电场中分离。样本中不同颗粒在电场内的迁移速度取决于它们的等电点和分离区分离缓冲液的pH值。同时,为了避免样本接触电极,作者使用了较高pH值的稳定缓冲液对电极进行包裹。待完成样本的分离后,再使用相应缓冲液通过逆向流的方式将样本的pH调整为中性。通过与分离室相连的毛细管,即可将分离后的各组分收集在96孔板中。随后,作者以国际细胞外囊泡协会提出的MISEV为准绳,对所得的EVs样本,从粒径、浓度、纯度、生化性质等多个维度进行了系统性评估。
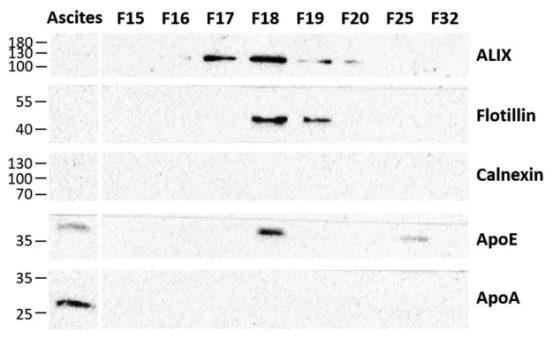
图2. 基于免疫印迹的FFE分离所得EV样本的蛋白分析
首先,通过免疫印迹方法对腹水来源EVs的标志蛋白(ALIX和flotillin-1)、脂蛋白标准蛋白(如HDL标记物-ApoA和ApoE-乳糜微粒/VLDL标记物)以及囊泡常见污染物主要蛋白(calnexin)进行了分析。如图2所示,ALIX和flotillin-1在分离得到的三个主要组分(F17-19)中被富集,而calnexin则完全没有被检测到。腹水中大量存在的脂蛋白ApoA、ApoE则用于评估最终EVs产品中的蛋白残留情况。该方法完全去除了腹水样本中高含量的Apo A蛋白。虽然在F18和F19中有检测到Apo E,但也有研究发现Apo E与EV相关。
图3. 基于电镜及NanoFCM的EVs单颗粒表征
进一步采用TEM以及NanoFCM对纯化所得样本在单颗粒水平进行了分析(图3)。TEM结果显示,FFE法分离得到的EVs中没有观察到典型的蛋白质团聚体以及脂质颗粒等污染。NanoFCM则进一步揭示了EV经典标志蛋白CD9、CD63和CD81的表达情况,其中CD9的阳性比例最高,可达56.1%,CD81和CD63的阳性比例分别为19.8%和13.0%,而CD9和CD63双阳性的比例仅为12%。作者还发现有15.2%的EVs表面有表达上皮细胞粘附分子EpCAM,提示该部分EVs可能来源于肿瘤细胞。NanoFCM进一步揭示四联体跨膜蛋白阳性EVs的粒径中位值为77 – 89 nm,而EpCAM阳性EVs的粒径相对更大,中位值为95 nm。
结论
Strandmann教授团队及其合作者结合免疫印迹、TEM和NanoFCM等多种表征方法,通过对FFE法进行优化,实现了从组成成分高度复杂的体液样本中快速、高通量地分离纯化得到EVs。结合NanoFCM检测平台,有望进一步实现EVs相关生物标志物的检测,从基础研究到临床应用均展现出巨大潜力。
参考文献
·Van Niel, G., Bergam, P., Di Cicco, A. et al.(2015). Apolipoprotein E regulates amyloid formation within endosomes of pigment cells. Cell Reports, 13, 43–51.
·Preußer, C., Stelter, K., Tertel, T. et al.(2022). Isolation of native EVs from primary biofluids—Free-flow electrophoresis as a novel approach to purify ascites-derived EVs. Journal of Extracellular Biology, 1, e71.