2022年高分文献精选:细胞外囊泡研究方法学篇
Author: Mika Huang Date: December 19, 2022
细胞外囊泡(extracellular vesicles, EVs)是由细胞分泌的具膜小囊泡,具有多种生物学功能,已有研究表明,EVs广泛参与机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等过程,在多种疾病和生理过程中扮演重要的角色。由于EVs的来源、分离纯化方法等存在差异,导致研究结果间的重复性和一致性不佳。制定EVs分离纯化和表征标准已然成为各个细胞外囊泡学会或团体讨论的热点。由中国研究生医院学会发布的《人间充质干细胞来源的小细胞外囊泡》和《人多能干细胞来源的小细胞外囊泡》两项团体标准自2022年1月1日起正式开始实施,厦门福流自主研发的纳米流式检测仪已经被纳入这两项标准中,用于干细胞来源的小细胞外囊泡的质量控制。
本期小编将带来2022年度细胞外囊泡研究方法学的4篇影响因子大于10分的文章,包含不同来源EVs的分离纯化、蛋白标志物评估、DNA定量分析等,这些文章的共同点是均选用纳米流式检测仪(Nano-Flow Cytometry, NanoFCM)进行单个EV的分析。
01 间充质干细胞来源的凋亡囊泡和外泌体的蛋白组学分析

关键词
凋亡囊泡、Fas、功能蛋白、A型血友病、间充质干细胞、血小板
研究摘要
凋亡囊泡(apoVs)是一种凋亡细胞来源的纳米级囊泡,在多种病理生理环境中起着至关重要的作用。然而,它们的详细特征、生物标志物和生物学特性尚未完全阐明。该研究比较了来自三种不同类型的间充质干细胞(MSC)衍生的apoVs和外泌体,包括人骨髓间充干细胞质干细胞(hBMSCs)、人脂肪间充质干细胞(hASCs)和小鼠骨髓间充质干细胞(mBMSCs)。建立了MSC衍生的apoV的独特蛋白质图谱,并确定了apoVs和外泌体在功能性蛋白质货物和表面标志物方面的差异。与外泌体相比,鉴定出了13个在apoVs中特异性富集的蛋白,它们可以作为apoVs特异性的生物标志物。此外,该研究还发现apoVs继承了凋亡相关因子Fas等亲代细胞的凋亡印记,通过与血小板的配体FasL结合以激活血小板功能,从而改善凝血因子VIII敲除小鼠的A型血友病症状、挽救凝血障碍。本研究首次系统表征了MSCs来源的apoVs的生物学特征,为apoVs的研究奠定了坚实基础,并首次阐明了apoVs通过Fas/FasL联动机制激活血小板、纠正凝血障碍的生物学功能,提示了apoVs在血友病A治疗中的潜在应用前景。
02 T细胞突触囊泡研究新方法

关键词
T细胞突触囊泡,珠状脂质双分子层,捕获技术,表征
研究摘要
免疫突触(immunological synapse)是抗原递呈细胞(antigen-presenting cell, APC)和T细胞相互作用的过程中,在细胞与细胞接触部位形成的一个特殊结构,是促进抗原、共刺激/共抑制、细胞因子三种激活信号从抗原递呈细胞传递到T细胞的分子枢纽。在与抗原递呈细胞作用过程中,T细胞会释放第四类信号—跨突触囊泡(trans-synaptic vesicles, tSV),介导免疫细胞之间的双向通信,但是它们作用的具体方式和原理仍不清楚。
该研究开创性地提出了脂质双分子层珠子(Glass Bead Supported Lipid Bilayers, BSLB)作为一种多功能的合成APCs来捕获、表征tSV,为研究tSV提供了一种新的检测手段。BSLB可促进来自受刺激T细胞的CD40L的转移,这在被转移的tSV组成的BSLB上留下了突触印记。该研究发现与细胞外囊泡(EVs)相比,tSV在大小、产量和免疫受体载体上都存在差异。此外,研究发现PD-L1与TSG101、ADAM10和CD81是决定CD40L囊泡释放的关键。最后,作者发现,与EV相比,tSV中有更多的RNA结合蛋白和更高含量的microRNA,再次验证了tSV作为细胞间信使的特殊作用。该研究开发了一种免疫细胞间信息传递和交流研究的新方法。
03 人血清和血浆来源细胞外囊泡的分离方法及不同亚群的评估

关键词
生物标志物,外泌体,细胞外囊泡,微囊泡,血浆,血清,亚群
研究摘要
背景
从血液中分离获得高纯度的细胞外囊泡(EV)对于疾病诊断生物标志物的发现和验证至关重要。血清和血浆的来源的EV都有相关的文献报道,但鲜有研究对不同来源的EVs进行比较。本研究旨在确定血浆和血清中不同EV亚群的存在。
方法
(如图1所示)采集健康受试者的血液,平行分离血浆和血清。使用ACD(浅黄色)或EDTA(紫色)管收集血浆,而在血凝块激活剂管中获得血清。利用以下三种方法纯化EV:
①碘克沙醇垫(iodixanol density cushion, IDC)和尺寸排阻色谱法(size exclusion chromatography, SEC)结合;
②免疫磁珠捕获系统(immuno-bead capturing, IBC),抗CD9、抗CD63和抗CD81的磁珠;
③IDC与碘克沙醇密度梯度离心(iodixanol density gradient,IDG)方法结合。
采用NTA、Western blot、SP-IRIS、常规流式细胞术和纳米流式检测技术、ELISA和质谱法分析不同分离方法获得的EV亚群。此外,作者还比较了不同的血浆分离方法获得的样品血小板残留的情况。
结果
本研究表明,与ACD血浆和血清相比,EDTA血浆中存在更多的CD9+EV,这些EV上存在CD41a,表明它们是从血小板中释放的。此外,血液中只有极少数的EV是呈CD63和CD81双阳性的。CD63+EV富含于血清,而CD81+EV在血浆和血清中都是最罕见的亚群。此外,使用EDTA管收集的血浆比ACD管收集血浆和血清含有更多的残留血小板,在EV分离前对样品进行两次离心对于降低血浆中的血小板残留至关重要。
结论
这些结果表明,人类血液中含有多个携带不同四次跨膜蛋白的EV亚群。血液取样方法,包括抗凝血剂的使用和离心方案的选择,都可能会影响EV分析,在发表文章时应做详细报告。
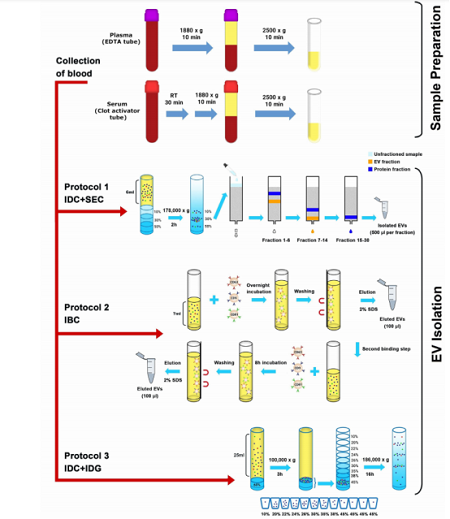

图1. 实验流程示意图
04 利用纳米流式检测仪分析单个细胞外囊泡的DNA

关键词
DNA,DNA酶消化,外泌体,细胞外囊泡,微囊泡,纳米流式检测仪,单颗粒分析
研究摘要
已有研究表明,细胞外囊泡(EVs)携带DNA,然而,EV中DNA(EV-DNA)的许多基本特征仍不清楚。本研究采用纳米流式检测仪(NanoFCM),散射光通道可检测粒径低至40 nm的单个EV的信号,荧光通道可实现SYTO 16标记的单个200 bp的DNA片段的检测(技术路线如图2所示)。通过同时对单个EV进行侧向散射和荧光(FL)检测并结合酶处理,本研究发现:
01 游离的DNA或与非囊泡实体相关的DNA大量存在于由细胞培养物制备的EV样品中(培养基经超速离心处理)
02 单个EVs中EV-DNA的数量表现出很大的异质性,DNA阳性(DNA+)EVs的数量在30%到80%之间变化,具体取决于细胞类型;
03 外部EV-DNA主要定位在相对较小的EVs上(例如,HCT-15细胞系<100 nm),通过抑制外泌体分泌途径可显著降低DNA+EVs 的分泌;
04 内部EV-DNA主要封装在相对较大的EV的内腔(例如HCT-15细胞系为80-200 nm);
05 双链DNA(dsDNA)是外部和内部EV-DNA的主要存在形式;
06 EVs中未发现组蛋白(H3),EV-DNA与组蛋白不相关;
07 基因毒性药物诱导DNA+EVs的释放增加,外部DNA+EVs和内部DNA+EVs的数量以及单个EVs中的DNA含量均显著增加。
这项研究为深入了解DNA与EV的相关性提供了直接和确凿的实验证据。
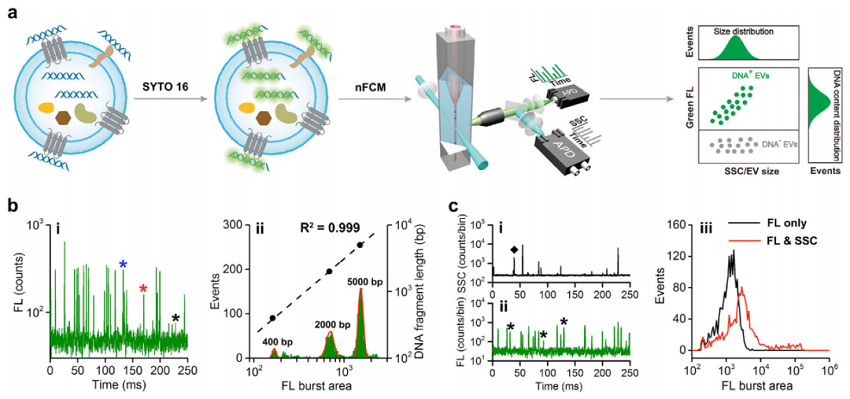
图2. EV-DNA标记和NanoFCM分析示意图
EVer福利
如您对于以上外泌体研究方法学文献感兴趣,欢迎扫描右方二维码,即可获取以上任意文献PDF版本,同时,还可申请纳米流式检测技术在各个方向的应用主题报告,我们将第一时间与您取得联系!