2022年高分文章回顾:细胞外囊泡的药物递送、靶向修饰和疾病治疗
Author: Mika Huang Date: January 12, 2023
纳米药物是指通过纳米技术将传统小分子化疗药物或蛋白、核酸等大分子药物,通过自组装或装载于纳米载体上形成的具有纳米尺度结构的一类药物。细胞外囊泡(extracellular vesicles, EVs)是一类由细胞分泌、具有磷脂双层膜结构的纳米颗粒,其凭借良好的结构稳定性、优异的生物相容性及天然的转运能力,被用于多种癌症的治疗研究,并体现出优于传统纳米药物的疗效。可通过人工装载蛋白、核酸和小分子药物等,结合靶向修饰策略将药物有效递送到相应部位,提高患者用药效率、降低给药频率以及减少全身暴露的副作用,细胞外囊泡已然成为全球寄予厚望的下一代革命性药物载体。相比于人工合成的纳米药物,细胞外囊泡作为治疗制剂和药物载体具有许多优势,如:
·可跨越血脑屏障;
·稳定性更高、提高用药效率、降低用药频率和相对易保存;
·免疫原性低且能够靶向到特定细胞和组织等。
推荐阅读(点击跳转原文)
本期小编将回顾2022年度纳米药物靶向修饰、药物递送及治疗相关的5篇影响因子大于10分的文章,包含靶向配体密度优化、工程化外泌体递送RNA和肽、外泌体T细胞免疫疗法,及外泌体在代谢调节、炎症缓解等方面的研究成果。
01 纳米药物表面靶向配体密度

关键词
脂质体纳米药物,配体密度,主动靶向,转铁蛋白,单颗粒检测,纳米流式检测
研究摘要
主动靶向被认为是进一步提高脂质体纳米药物疗效的最有前途的策略之一。由于配体密度在介导细胞摄取中的关键作用及脂质体载体本身的异质性,在单颗粒水平对脂质体表面偶联的配体数量及其密度分布进行准确定量,对揭示其功能化程度,并阐明功能化与纳米药物的靶向结合细胞能力的影响至关重要。
本研究报道了一种新的技术方法(如图1所示),该方法可以同时测量脂质体颗粒的大小和配体的数量,从而确定每个脂质体的配体密度。该分析方法速率高达每分钟10,000个粒子,几分钟内即可快速获得具有统计代表性的配体密度的分布。利用荧光标记的重组受体作为检测探针,仅具有细胞靶向能力的配体可被检测到。该研究同时探索了配体加入量、偶联策略以及高聚物链的长度等因素对叶酸修饰的脂质体配体密度的影响。对三种不同靶向配体修饰的脂质体,定量阐明了活性配体密度和细胞靶向能力之间的关系。研究发现,叶酸、转铁蛋白和HER2抗体偶联脂质体的最佳配体密度分别为每100nm2 0.5−2.0个,0.7个和0.2个,该数值与绝大多数天然病毒表面的刺突蛋白密度相近。该方法在纳米药物主动靶向研究中具有普适性。
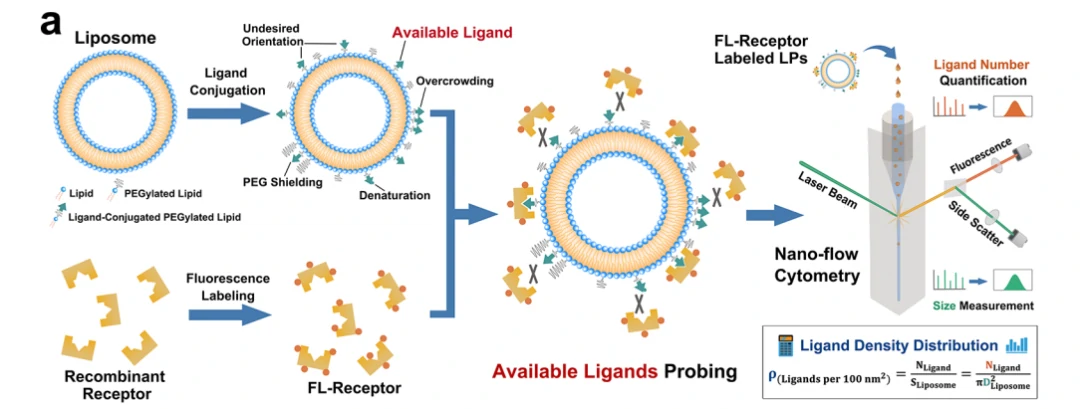
图1. 配体结合脂质体的制备和配体定量过程技术路线图
02 红细胞来源EVs靶向治疗白血病

关键词
红细胞来源的细胞外囊泡,工程化外泌体,microRNA,多肽
研究摘要
近年来,新疗法的涌现迫切需要安全的、无免疫原性的药物递送载体,期待该载体能够将治疗制剂靶向递送至病变细胞,从而提高治疗效果并减少副作用。细胞外囊泡(EV)由于具有转移生物活性物质的先天优势和优异的生物相容性,被视为一种潜在的理想药物递送载体倍受关注。然而,天然EV的治疗潜力是有限的,工程化的EV要达到满足治疗使用所需的效率、稳定性、安全性和生物相容性水平,仍需要克服许多挑战。
该研究提出一种酶介导的结合链霉亲和素的偶联使EVs表面功能化,使用该方法的表面功能化可以实现多肽、单域抗体和单克隆抗体等在EV表面以高拷贝数且稳定地结合。在体内和体外实验中,功能化的EV在表达常见癌症相关标志物(如CXCR4、EGFR和EpCAM等)的靶细胞中累积。通过该功能化策略进一步将治疗性反义寡核苷酸(antisense oligonucleotides, ASO)递送到转移性乳腺肿瘤模型中,从而增加了靶向致癌microRNA的敲除,提升转移抑制能力。该方法也可以用于将EVs表面修饰上双功能的肽段,可以在靶向白血病细胞的同时诱导细胞凋亡,从而抑制疾病进展。
此外,本研究还进行了广泛的测试,证实了工程化EVs用于治疗的生物相容性和安全性,并没有发现不良反应。这种工程化的EV为药物的靶向递送提供了很有前景的手段,同时很好的解决了药物递送安全性的问题。
03 工程化树突状细胞外泌体在免疫治疗中的应用

关键词
工程化外泌体,CAR模拟,T细胞疗法,免疫疗法,实体瘤
研究摘要
嵌合抗原受体T(CAR-T)细胞疗法在治疗血液系统恶性肿瘤的临床研究中已取得了显著的效果。尽管CAR-T疗法未来可期,但持续的研究也发现,CAR-T疗法对于实体肿瘤的治疗效果并不尽如人意。此外,CAR-T细胞还存在生产耗时长,储存和运输困难等问题,往往会延误患者的治疗。
受CAR-T疗法的启发,本研究将抗原喂养的树突状细胞产生的外泌体表面进行抗体修饰,通过原位T细胞活化和癌细胞靶向,用于实体瘤的超CAR-T治疗。该研究证实,肿瘤抗原刺激的树突状细胞产生的外泌体(tDC-Exo)提供了主要的组织相容性(MHC)-抗原复合物和CD86共刺激分子,它们与CAR-T细胞的CAR相同,充当T细胞激活的必要信号。抗CD3抗体和抗EGFR抗体工程化修饰到tDC-Exo表面,促进T细胞与肿瘤细胞的结合,从而进行精确治疗。Exo-OVA-aCD3/aEGFR在小鼠肿瘤模型中表现出优异的抗肿瘤活性,并且能有效抑制肿瘤复发和转移,技术路线如图2所示。值得一提的是,研究者发现Exo-OVA-aCD3/aEGFR在增强抗肿瘤免疫反应的同时,促进了肿瘤细胞PD-L1的表达。
通过联合PD-L1抗体的免疫阻断治疗,有效地降低了肿瘤细胞的免疫逃逸,进一步增强了Exo-OVA-aCD3/aEGFR对实体瘤的治疗作用。这项研究为开发针对实体瘤的类CAR-T治疗策略提供了新的思路。
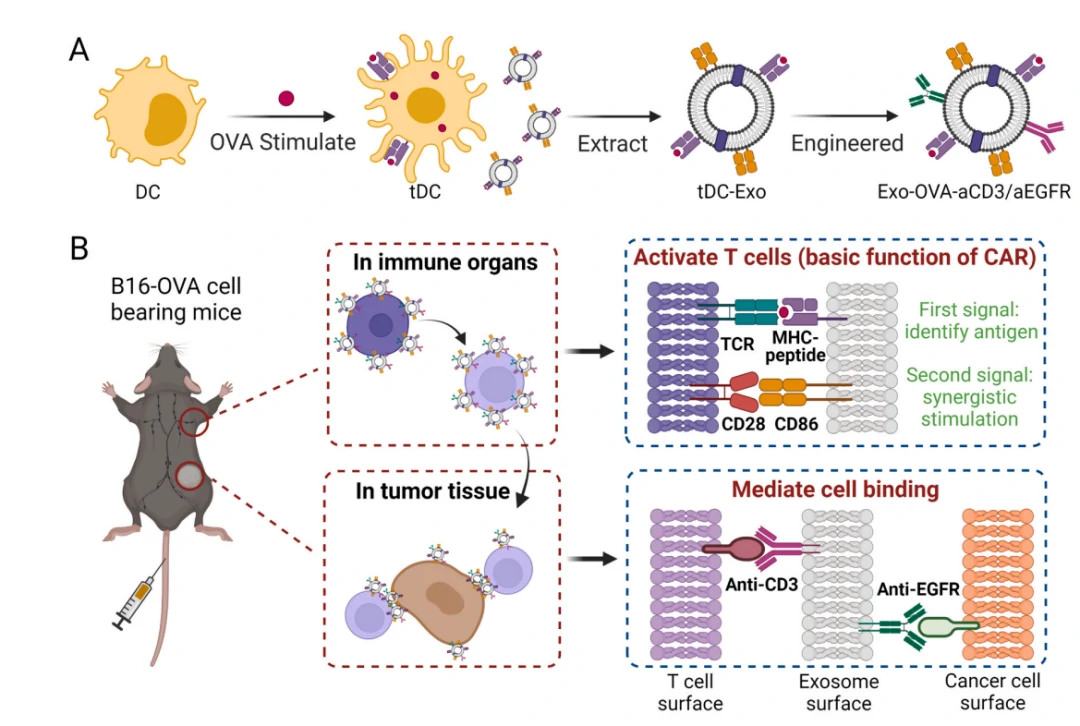
图2. 技术原理示意图
(A)抗CD3和抗EGFR抗体工程化的tDC-Exo(Exo-OVA-aCD3/aEGFR)的构建示意图。
(B)MHC抗原复合物和Exo-OVA-aCD3/aEGFR上的共刺激分子CD86,相当于CAR-T细胞的CAR,可激活体内的T细胞。抗体的移植随后会与激活的T细胞结合,同时靶向癌细胞,这一过程模拟了CAR-T疗法。
04 胞外囊泡滋养皮肤和生发

关键词
凋亡,细胞外囊泡,代谢调节因子,皮肤系统,间充质干细胞
研究摘要
人的机体中每天有超过3000亿个细胞死亡,产生大量内源性凋亡细胞外囊泡(apoEV)。此外,异体干细胞移植是目前临床实践中常用的治疗手段,也会产生外源性apoEV,巨噬细胞通过吞噬和消化apoEV来维持机体的稳态。
本研究发现一部分外源性apoEV在外皮和毛囊中代谢产生,且外源性apoEV通过激活皮肤和毛囊间充质干细胞中的Wnt/β-catenin通路,促进伤口愈合和毛发生长。经尾静脉注射apoEV后让小鼠跑步机训练模拟力量增强模型,悬尾实验模拟失重模型,结果发现悬尾抑制apoEVs的释放。进一步实验结果发现,apoEV的迁移通过跑台运动增强,而受悬尾抑制,这与循环中机械力调控的DKK-1(Dickkopf-1)的表达有关。该研究揭示了以前未被意识到的apoEV代谢途径,并为探索基于apoEV的皮肤和头发疾病治疗开辟了一条新途径。
05 小细胞外囊泡与肾小管间质炎症

关键词
肾小管上皮细胞,KIM-1,肾小细胞外囊泡,缺氧诱导
研究摘要
肾小管上皮细胞(tubular epithelial cells, TECs)暴露于缺氧条件下会引起肾小管间质炎症(tubulointerstitial inflammation, TII),但确切机制尚不清楚。在本研究中,作者发现缺氧诱导的肾小管损伤,可以通过肾小管缺氧诱导因子(tubular hypoxia-inducible factor-1a, HIF-1α)和肾损伤分子-1(kidney injury molecule-1, KIM-1)的表达来验证,并且随着缺血-再灌注损伤(ischemia-reperfusion injury, IRI)后,肾小细胞外囊泡(sEV)的分泌随着肾小管间质炎症的发展而增加。有趣的是,KIM-1阳性的小管被巨噬细胞包围,并与sEV共定位。在体外,缺氧的TECs中KIM-1的表达和sEV的释放增加,当抑制sEV分泌的主要调节因子KIM-1和Rab27a基因时,缺氧诱导的炎症反应得到改善。KIM-1被认为介导TECs对缺氧TEC衍生sEV(Hypo-sEV)的摄取。磷脂酰丝氨酸(phosphatidylserine, PS)是KIM-1的配体,通过纳米流式检测发现PS存在于低氧诱导产生的sEV中。相应地,当KIM-1被敲除时,外源性Hypo-sEV诱导的炎症反应减弱。体内实验证实,外源性Hypo-sEV与KIM-1阳性小管共定位时,使IRI小鼠的肾小管间质炎症加重。
该研究表明,损伤小管表达的KIM-1通过识别PS介导sEV的摄取,PS参与了缺氧诱导的小管炎症的扩增,导致缺血性急性肾损伤中肾小管间质炎症的发生。
EVer福利
欢迎扫描下方二维码,即可获取以上任意文献PDF版本,同时,还可申请纳米流式检测技术在各个方向的应用主题报告,我们将第一时间与您取得联系!