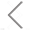Carmine创始人团队:红细胞来源EVs靶向治疗白血病
Author: Mika Huang Date: October 20, 2022
急性髓系白血病(Acute Myeloid Leukaemia, AML)是最高发的一种成人血癌。虽然 2/3 的AML患者经化疗和靶向治疗后能达到完全缓解,但是高达60% – 65%的年轻成人患者会在三年内复发,致使生存率急剧下降。治疗性的寡核苷酸(ASO)可高特异性地与癌基因结合,并使其沉默,是一种极具前景的AML治疗策略。然而,目前可安全、有效递送ASO的方法还相对匮乏。
细胞外囊泡(EVs)作为新一代的递送工具,在解决ASO递送难题中极具潜力。然而由于产量的限制,基于EV的药物递送方法尚处在早期阶段。血细胞是非常理想的EVs来源。在细胞体外培养体系中,细胞密度通常为~1E6 cells/mL,但人血液中的红细胞(red blood cells, RBC)浓度就可高达5E6 cells/uL。因此,RBCs来源的EVs(RBCEVs)在作为递送载体时具有其天然优势。
新加坡国立大学的Minh T. N. Le团队及合作者们建立了大规模纯化RBCEVs的标准方法,从每单位的血液(200 mL全血)中可以快速获取高达1013-1014 EVs,这些RBCEVs被用于装载包括ASOs、gRNAs以及Cas9 mRNA在内的多种核酸药物,在人类细胞和异种移植小鼠模型中均展示出高度稳定的miRNA抑制以及CRISPR-Cas9基因编辑能力。

近日该团队在Cell Proliferation(IF = 8.8)上发表题为“CD33-targeting extracellular vesicles deliver antisense oligonucleotides against FLT3-ITD and miR-125b for specific treatment of acute myeloid leukaemia”的研究型文章。通过对红细胞来源的EVs(Red Blood Cell-derived EVs, RBCEVs)表面修饰靶向抗体和内部装载ASO,开发了一种用于AML治疗的靶向ASO药物递送系统,极大地提高了治疗效果(图1)。
结果显示,靶向修饰了CD33抗体的RBCEVs可以被AML细胞高效吸收,同时RBCEVs内部装载的ASO则显著降低了AML细胞中FLT3-ITD或miR-125b的水平。
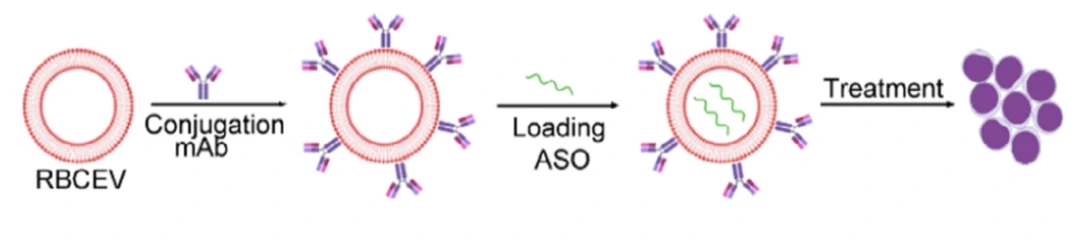
图1. 红细胞来源EVs的工程化流程图
红细胞来源的RBCEVs可以被白血病癌细胞吸收,也会在非癌细胞中积累,CD33作为一种常见的白血病标志蛋白,在绝大多数AML细胞表面高表达。由于成熟红细胞缺乏基因组,无法通过基因工程手段对其改造,作者创新性地开发了一种酶—生物素/链霉素—抗体连接的新策略,以实现靶向蛋白与EVs的稳定、高效连接 (图2)。
 图2. EVs表面靶向抗体修饰策略
图2. EVs表面靶向抗体修饰策略
作者首先利用NanoFCM对该靶向抗体的修饰结果进行了分析,结果表明成功修饰CD33抗体的EVs可达74.8%,且同型对照IgG的修饰比例为73.6%,说明该方法在连接过程中对修饰蛋白本身无选择性,理论上可用于在EVs表面修饰任何感兴趣的目标蛋白。
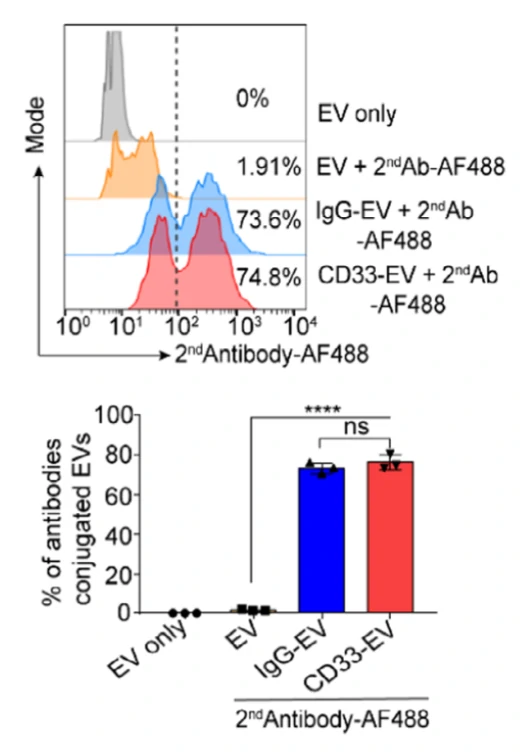 图3. NanoFCM评估EVs靶向抗体修饰效果
图3. NanoFCM评估EVs靶向抗体修饰效果
后续作者验证了修饰CD33抗体的RBCEVs可被AML细胞高效吸收。体内实验表明,CD33修饰的EVs可以显著的在小鼠骨髓、肝脏、脾脏等部位富集,表明CD33抗体的修饰,使得RBCEVs可特异性的进入白血病相关细胞。作者进一步在RBCEVs中分别装载FLT3-ITD ASO和miR-125b ASO这两种药物,结果显示这些装载了ASO的RBCEVs可以显著抑制白血病的进展。
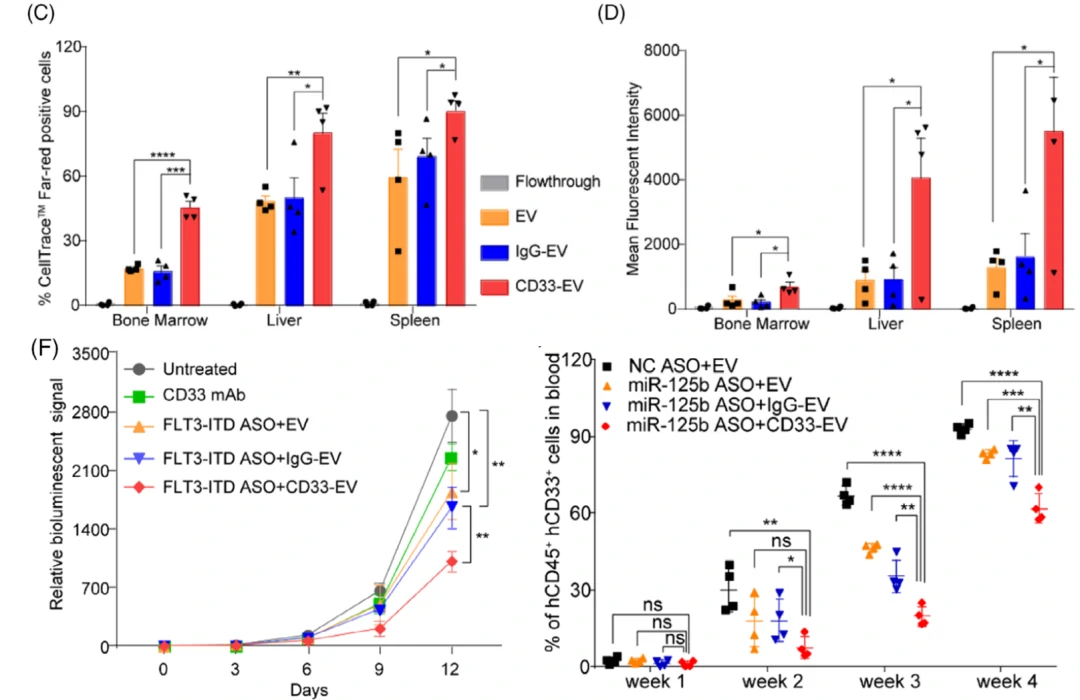
图4. 靶向修饰和装载ASO的RBCEVs治疗白血病效果
总结
使用人类红细胞作为递送治疗性RNA的EVs的来源,有以下优点:
1.无细胞核和线粒体DNA,有效避免了水平基因转移的风险;
2.红细胞数量多,是人体内最丰富的细胞类型(其含量占所有体细胞的84%);
3.红细胞易获取,几十年来的常规输血已经证实了它的安全性;
4.RBCEVs稳定性好,在-80℃条件下可长期稳定保存,即使经过多次冻融仍可维持结构完整。基于电穿孔等成熟装载方法,可有效实现RBCEVs中ASOs的装载,且该表面蛋白修饰策略的开发也极大提高了RBCEVs靶向AML相关细胞的能力,从而显著抑制白血病的进展。
RBCEVs的递送策略加速和推进着治疗性ASOs的临床转化,这将为白血病患者带去福音。

本文的通讯作者Minh T. N. Le博士是Carmine Therapeutics的创始人和Advisor。Carmine Therapeutics是一家专注于利用红细胞膜EVs发展创新基因疗法的生物科技企业,公司愿景是使基因药物广泛普及,以满足患者未满足的医疗需求。在2020年6月,Carmine与武田制药签订超9亿美元的科研合作协议,致力于发现、开发以及商业化非病毒基因疗法,基于前者开发的红细胞胞外囊泡的REGENT平台实现两种罕见疾病相关靶标的开发和商业化。
参考文献
· Chen H, Jayasinghe M K, Yeo E Y M, et al. CD33‐targeting extracellular vesicles deliver antisense oligonucleotides against FLT3‐ITD and miR‐125b for specific treatment of acute myeloid leukaemia[J]. Cell Proliferation, 2022: e13255.
· Pham C T, Zhang X, Lam A, et al. Red blood cell extracellular vesicles as robust carriers of RNA-based therapeutics[J]. Cell Stress, 2018, 2(9): 239.
· Usman W M, Pham T C, Kwok Y Y, et al. Efficient RNA drug delivery using red blood cell extracellular vesicles[J]. Nature communications, 2018, 9(1): 1-15.