冉冉升起的明日之星——疾病诊断篇
Author: Mika Huang Date: November 3, 2023
细胞外囊泡(extracellular vesicles, EVs)作为细胞间信息传递的重要载体,其运载的蛋白质、核酸、脂质等生化分子在疾病的早期筛查、预后检测和药物的疗效评估中具有重大潜力和临床应用价值。相比于传统生物标志物,EVs与细胞的生理状态联系紧密,可实时反映疾病的发生发展过程;此外,EVs来源广泛且含量丰富,可以从尿液、血液、唾液和眼泪等生物液体中获得,并可跨越血脑屏障等生物组织屏障。
来自美国化学协会的学者检索并分析了CAS数据库中EVs在治疗和诊断领域中应用研究的发表情况。如图1所示,EVs在多种疾病的治疗和诊断被广泛研究,其中与癌症相关研究更是备受关注,文章数量占比高达68%。
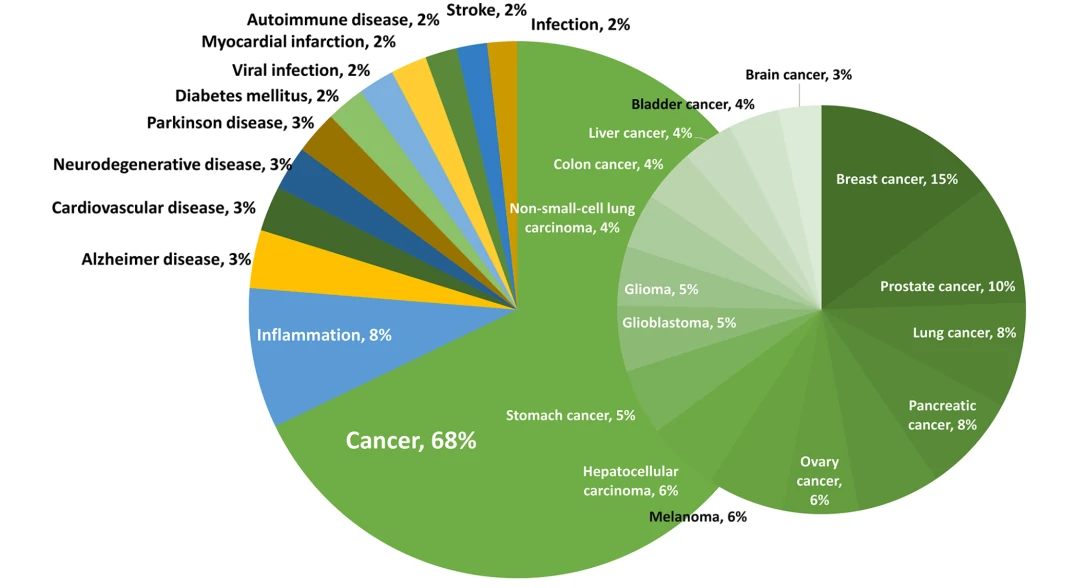
图1. EVs在疾病治疗和诊断中的应用相关的文章分布
01 基于EVs蛋白的诊断方法
蛋白质作为EVs的重要组分,一直以来都是领域内的研究热点。四次跨膜蛋白(Tetraspanins)作为EVs中蛋白丰度最高的一类膜蛋白,被用于多种疾病的诊断和检测。其中,CD63在各种类型的人类癌症细胞分泌的EVs中升高,如黑色素瘤患者血浆中CD63蛋白阳性的EVs的浓度显著提高。CD81则在丙型肝炎中发挥着关键的作用,与炎症和纤维化相关,被认为是丙型肝炎诊断标志物。CD151、CD171和TSPAN8则在肺癌患者的血清EVs中的表达量显著提高。
来自厦门大学颜晓梅教授团队通过NanoFCM分析了正常肠上皮细胞和结直肠癌细胞来源的EVs,发现结直肠癌细胞分泌的EVs中表达CD147的类群所占的比例远高于正常肠细胞。在此基础上进一步发现健康人和结直肠癌患者血浆中CD147阳性的EVs颗粒浓度存在显著差异,且这种差异在Ⅰ期患者中即可体现。该团队测定血浆中表达EBV编码的膜蛋白LMP1和LMP2A,以及其他肿瘤标志物PD-L1、EGFR和EpCAM的EVs颗粒浓度,建立了快速、可靠、无创的鼻咽癌诊断方法;同时发现了LMP1和LMP2A阳性的EVs在甄别鼻咽癌和鼻咽炎方面具有临床潜力(参见往期文章:厦大团队揭秘如何通过EVs区分癌症和炎症)。
此外,尿液中EVs含量丰富,且无侵入性、易获得也引起了大家的关注,被广泛用于疾病筛查。例如,尿液的EVs被发现是膀胱癌、前列腺癌和肾癌等泌尿系统疾病的潜在生物标志物。
表1. 常见可应用于液体活检的EVs蛋白

02 基于EVs核酸的诊断方法
由于受到脂质双层脂膜的保护,EVs运载的核酸片段可免于被体液中RNA酶降解的命运。其中EVs所运载的miRNA分子是最为常见的诊断靶标,如下表2所示,EV-miRNA已被用于非小细胞肺癌、肺癌、乳腺癌、前列腺癌、肠癌等不同类型癌症的诊断研究中。来自路易斯维尔大学的Guilherme Rabinowits等通过核酸测序结果发现肺腺癌患者血液中EV-miRNA与对照组具有差异显著,说明EV-miRNA在肺腺癌筛查的潜力。哈肯萨克大学医学中心的研究人员发现EVs中miR-141被发现可作为前列腺癌的有效诊断标志物,且目前正在招募临床试验者(NCT03694483),以开发基于EVs miR-141的前列腺癌症液体活检方法。而美国Exosome Diagnostics公司则开发了一种基于尿液EVs的简单液体活检方法——ExoDx,该方法使用EVs中ERG、PCA3和SPDEF的RNA拷贝数来实现前列腺癌的早期筛查。除癌症之外,EV-RNA也被用于心血管疾病、肾纤维化以及病毒感染等疾病的诊断中。例如,来自温州医科大学的研究者研究了泪液来源EVs中的miR-145-5p、miR-214-3p、miR-218-5p和miR-9-5p与糖尿病视网膜病变发展过程密切相关。
然而,目前针对EV-RNA的分析方法往往通过RNA提取后,再进行采用qRCR或者核酸测序技术进行分析。EV-miRNAs的原位分析可能为解决上述缺点提供了另一种策略,即通过将特定的探针加载到单个EV中,使探针与miRNA结合并放大miRNA信号来直接检测,从而避免EV裂解和RNA提取。来自南方医科大学南方医院的研究者提出EV-miRNA的原位分析技术,即基于DNA纳米线引导催化的发夹组装系统(NgCHA)的EV-miRNA原位检测,该团队进一步结合NanoFCM实现了单EVs水平对于某一特定序列miRNA的表达分析,其性能优于传统的CHA和MB探针,该方法拓展了EV-RNA作为诊断工具的应用价值和临床潜力。
表2. EV-miRNA在癌症诊断中的应用

03 EVs相关诊断标志物临床获批情况
目前,EVs在疾病诊断的应用仍处于转化医学研究阶段,获得监管部门批准和商业应用的产品较少。2016年,Exosome Diagnostics公司的EVs癌症诊断产品ExoDx Lung(ALK)获批上市,成为全球首个获批的EVs诊断产品,基于简单的尿液EVs液体活检方法,该方法可快速检测出前列腺癌患者中的EML4-ALK突变,达到了88%的灵敏度和100%的特异性,可用于协助早期诊断前列腺癌,避免不必要的前列腺活检,该方法已于2019年获得FDA认证。
Biological Dynamics开发了一种早期诊断检测,利用交流电动力学(ACE)从血液中分离EVs,研究表明该检测可在肿瘤Ⅰ期就识别胰腺癌。2023年Biological Dynamics宣布完成了其实验室开发测试(LDT)的分析和临床验证,且目前正在推进与多中心合作进行胰腺癌早筛临床试验,加快该技术以LDT模式落地的探索过程。近期Biological Dynamics在《肿瘤学前沿》上发表病例报告“通过EVs液体活检的多模式方法早期检测胰腺癌前病变”。
国内方面,2022年2月,中国NMPA授予了上海思路迪的EVs卵巢癌辅助诊断试剂盒(化学发光法)以优先审批,是国内首款同品种产品获准注册的医疗器械。此外,尧景基因基于糖链细胞外囊泡开发的GlyExo-Capture技术并基于该技术开发的肝癌检测试剂盒已完成注册检验,目前正在开展多中心临床研究,对于细胞外囊泡技术走向临床应用具有里程碑意义。
04 EVs分离纯化方法的评估
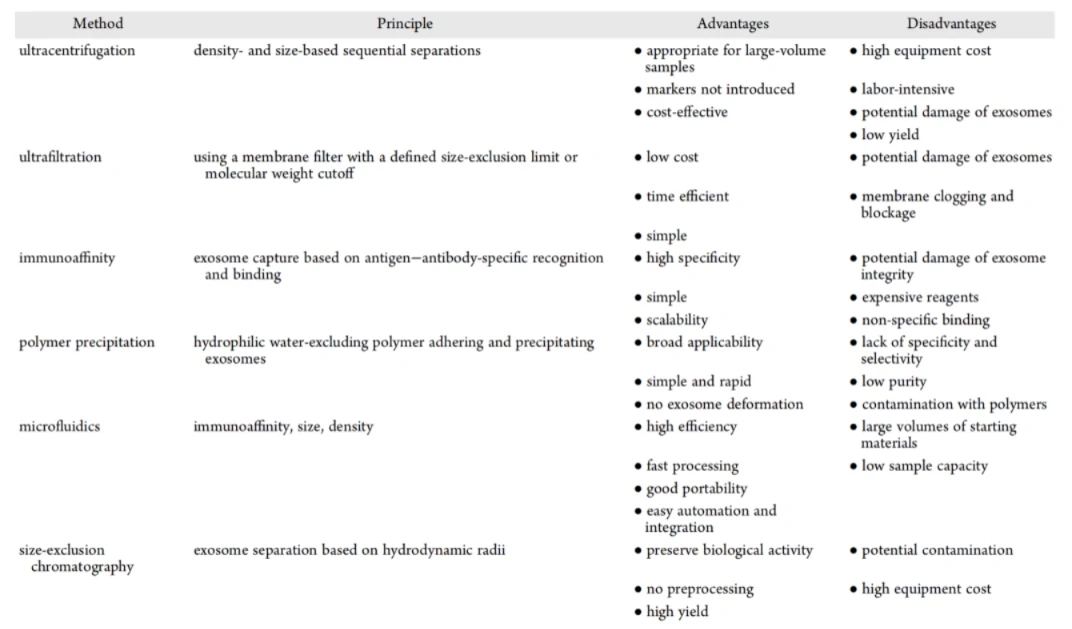
EVs往往存在于组成成分高度复杂的体液之中,而如何从复杂的体液中以最少的样本量获得高纯度的EV样本,一直是该领域中亟需突破的瓶颈。表3所示是常用的EVs纯化方法,无论是经典的超离法,还是新进发展的聚合物沉淀、免疫捕获以及超滤等方法,均展现了各自的优势和局限性。然而不管选用何种分离纯化方法,都需要进行严格的质量控制以确保EVs的富集效率和样本纯度。
1.超速离心法
基于多次差速离心和100,000 g左右的强离心力实现EVs的分离纯化,是目前最常用的EVs分离方法之一。然后该方法较为费时费力,且易造成样本的大量损失。而密度梯度离心则是在差速离心法的基础上进一步通过铺设密度层,利用密度这一性质以实现EVs和其他杂质的再度分离,以获取更高纯度的EVs样本。
2.超滤法
一种基于尺寸的EVs分离纯化方法,通过具有特定孔径(限制了它们的分子量和尺寸)的膜过滤器来实现EVs的截留和分离。
3.尺寸排阻色谱(SEC)
则利用不同大小的颗粒流经填充柱的路径和时间差异以实现EVs和其他粒径较小的杂质颗粒的分离。目前SEC已用于从血浆、尿液、唾液和眼泪等体液中分离、纯化和富集EVs。
4.聚合物沉淀法
通过聚合物对EVs进行包裹,借助低速离心的方法使EVs从生物体液中沉淀出来。这种方法易于操作,可应用于大量样本的处理;然而该方法往往也会伴随着体液中其他杂质颗粒的分离,且引入聚合物粒子而影响获得的EVs样本纯度。
5.微流控装置
可以在微小的通道内基于尺寸、密度和免疫亲和性等特性来实现EVs的分离纯化。微流控装置体积小,且该方法样本需求量低,在降低了时间和试剂花费的基础上,可快速获得纯度较高的EVs样本;然而该方法也存在着装置较为复杂、价格昂贵和对操作者需要一定的实验技能等要求。
6.免疫亲和法
利用抗体和 EVs表面蛋白之间的相互作用来分离EVs。目前已有方法利用EVs膜表面的磷酯酰丝氨酸(Phosphatidylserine, PS)、CD9和CD63等生物分子与受体蛋白Annexin V以及对应抗体的高度选择性和亲和性,实现细胞培养上清液、血浆、尿液等多种体液中的EVs的分离纯化以及高效标记,实现短时间、高纯度、结构完整的EVs获取以及标记。整个过程基于磁分离进行,使得EVs的捕获及标记洗涤简单易行。
表3. 用于EV分离纯化的主要方法
基于不同来源EVs的高度异质性以及来源环境的复杂性,如何实现分离纯化和质量控制,都是其临床应用的限速步。EVs粒径分布广(40-1000 nm),但是主要集中分布于200 nm以下。结合瑞利散射和鞘流单分子荧光检测技术,厦门福流生物创始团队研发成功具有自主知识产权的纳米流式检测技术,该技术可实现低至7 nm的纳米金颗粒和24 nm低折射率二氧化硅纳米颗粒散射光的直接检测;同时配备多色荧光检测功能,进一步揭示颗粒的生物化学性质。纳米流式检测技术使得研究人员能够像使用传统流式细胞仪分析细胞那样对EVs进行多参数定量检测。如下图2所示,通过对单个纳米颗粒(7-1000 nm)的粒径、浓度以及生物化学性质的高分辨、高选择性、高通量检测,为生命科学研究以及生物医药产业的发展提供了一个强有力的表征手段。
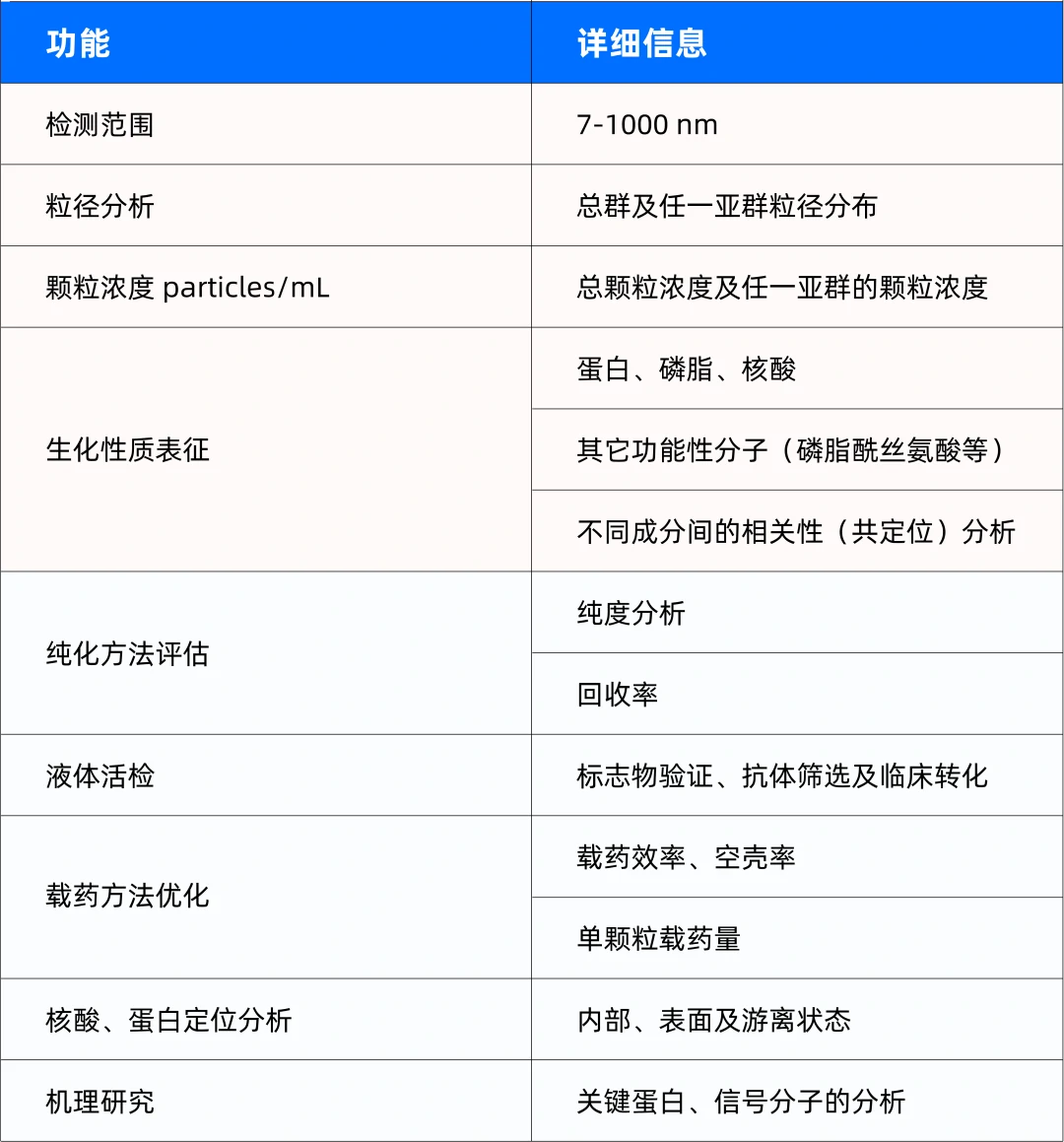

图2. 基于NanoFCM的EVs单颗粒水平分析
A. EVs的粒径表征;B. 经跨膜核酸染料标记,EVs的核酸分析;C. EVs表面蛋白CD9和CD63的共定位分析
EVers福利
为助力EVs液体活检方向研究,欢迎领域的研究者扫描下方二维码申请试用。

参考文献
-
Rumiana Tenchov, Janet M. Sasso, Xinmei Wang, et al. Exosomes-Nature's Lipid Nanoparticles, a Rising Star in Drug Delivery and Diagnostics[J].ACS Nano, 2022, 16, 17802−17846.
-
Tian Y, Ma L, Gong M, et al. Protein Profiling and Sizing of Extracellular Vesicles from Colorectal Cancer Patients via Flow Cytometry[J]. ACS Nano, 2018, 12(1), 671-680.
-
Yunyun Hu, Ye Tian, Haonan Di, et al. Noninvasive Diagnosis of Nasopharyngeal Carcinoma Based on Phenotypic Profiling of Viral and Tumor Markers on PlasmaExtracellular Vesicles[J]. Anal. Chem, 2022, 94(27), 9740–9749.
-
Zhang Y, Wu Y, Luo S, et al. DNA Nanowire Guided-Catalyzed Hairpin Assembly Nanoprobe for In Situ Profiling of Circulating Extracellular Vesicle-Associated MicroRNAs[J]. ACS sensors, 2022,7(4),1075–1085.



