当外泌体和免疫治疗“狭路相逢”
Author: Mika Huang Date: October 29, 2021
2021年9月,美国国家癌症研究所(National Cancer Institute, NCI*)通过了一项高达1170万美元的优秀专科研究项目(Specialized Program of Research Excellence, SPORE*),用于研究黑色素瘤中的外泌体和免疫治疗,获得资助的单位为Penn Medicine和Wistar研究所。这项为期五年的项目将会资助三个创新的黑色素瘤研究课题,旨在将宾夕法尼亚大学Perelman医学院和Wistar研究所的基础实验发现转化为治疗皮肤癌症的新疗法。
皮肤癌是最常见的癌症类型。主要分为鳞状上皮细胞癌,基底细胞癌和黑色素瘤三种。相比于其它类型的皮肤癌,黑色素瘤并不常见(约占1%),但是它最有可能入侵周围组织引起全身转移,所以也最凶险。根据NCI的数据,预计2021年仅在美国就会出现超过10万的新发黑色素瘤病例。黑色素瘤发病率在过去二十年间持续攀升,如果早期发现早干预,黑色素瘤是可以治疗的,5年生存率可达91.7%。然而,这些癌症如果转移了,后果将是致命的。
近几年的肿瘤治疗领域,黑马无疑是免疫治疗。毫无疑问,免疫治疗正在显著地改变着许多癌症患者的治疗前景。尤其是PD-1/PD-L1抗体更是肿瘤界霸屏的霸主,被尊称为“神药”。事实上,免疫检查点抑制剂最初就是用于治疗黑色素瘤。与以往的肿瘤治疗方案相比,PD-1抗体的特点在于:一旦对患者起效,其疗效可以维持较长时间,甚至可以消除肿瘤达到临床治愈。以帕博利珠单抗(Pembrolizumab, Keytruda, “K药”)和纳武单抗(nivolumab, Opdivo, “O药”)为代表的PD-1抗体药已经奠定了治疗晚期转移或不可切除黑色素瘤的领导地位。然而,PD-1抗体并非对每一个黑色素瘤患者都有效,临床试验结果表明,仅有不到50%的患者能够从PD-1抗体免疫治疗中获益。
目前还没有一种经 FDA 批准的分析方法能够帮助临床医生确定哪一种类型的黑色素瘤患者会对某种免疫治疗有响应。具体选用哪种抗体药,临床上通常由经验丰富的医生来帮助判断,一旦选择出现偏差,很可能丧失其它疗法的治疗时机,造成人财两空的悲剧。2021年美国国家癌症研究所赞助的黑色素瘤的SPORE项目有望改变这一现状,来自Penn Medicine和Wistar的申请团队将会进行严格的临床应用研究,探索黑色素瘤中的外泌体和免疫治疗的关系,计划通过基于血液中外泌体的检测高度灵敏和特异地预测黑色素瘤对免疫治疗的响应,给黑色素瘤患者带来福音。
NATURE:外泌体PD-L1与免疫治疗——初识
事实上这并不是Penn Medicine和Wistar组合头一次“搞事情”,故事还得从2018年Nature上的一篇文章说起。
外泌体是细胞分泌产生的一类小囊泡,携带丰富的生物活性分子(如蛋白质、RNA、磷脂等),可以参与受体细胞的功能调控,影响细胞微环境。Chen等发现肿瘤细胞可通过释放表面富含PD-L1的外泌体到外周血从而抑制肿瘤杀伤性T细胞的功能。以往的研究认为PD-L1主要存在于肿瘤细胞表面,该研究首次证实PD-L1在肿瘤细胞分泌的外泌体上富集,且含量远高于肿瘤细胞。肿瘤细胞分泌的带PD-L1的外泌体(exoPD-L1)可以进入机体的血液循环,并在杀伤性T细胞到达肿瘤之前就截杀它,全面抑制其功能,使机体的免疫系统“不战而屈人之兵”。
更值得关注的是,该研究揭示了肿瘤患者血液中exoPD-L1的丰度可以有效预测该患者对PD-1抗体免疫治疗的反应性。治疗前血液中exoPD-L1水平低的患者往往更有可能从免疫治疗中获益。治疗后exoPD-L1水平则是另外一回事,治疗3-6周后exoPD-L1上升显著的患者肿瘤缩小得最多。再次印证血液中的exoPD-L1水平可以作为制定治疗方案的辅助。
治疗前后exoPD-L1水平变化看似矛盾的结果实际从生物学上是说得通的。这里边可能涉及两个过程:治疗前,exoPD-L1水平反映肿瘤的大小或疾病的程度;治疗一段时间后,exoPD-L1的快速提升意味着T细胞被激活了,也就是说机体的免疫抑制已经解除,免疫系统有能力发挥作用,杀伤肿瘤细胞。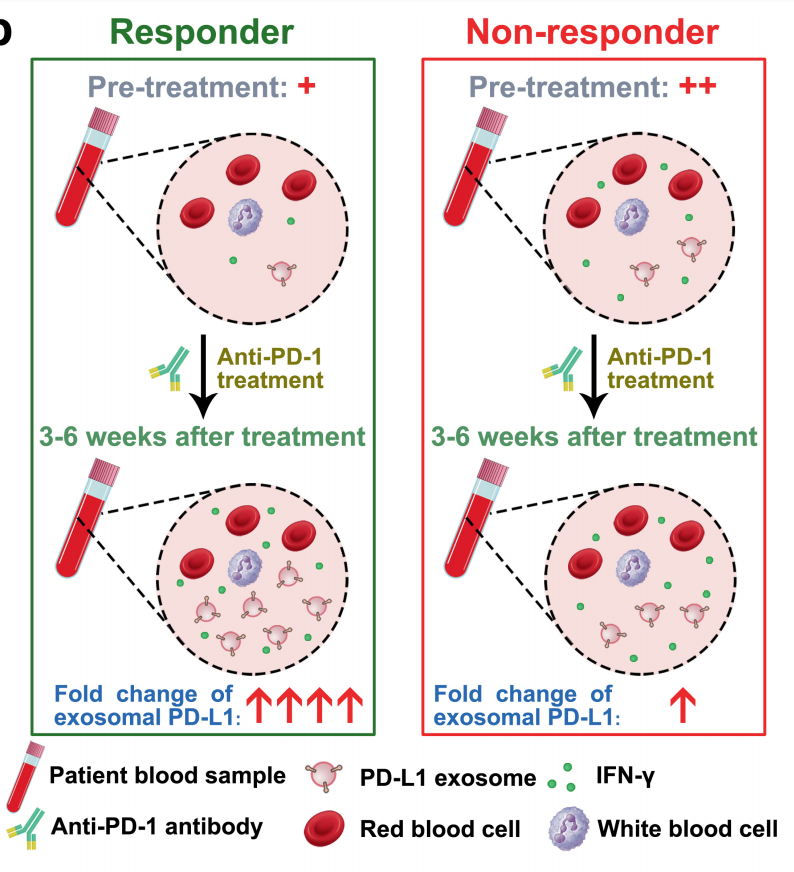
图1.循环外泌体PD-L1在预测患者抗PD1治疗反应中的潜在应用
JEV:外泌体PD-L1临床验证
来自法国国家健康与医学研究院的Gessica Gobbo与其合作伙伴做了后续的跟进研究,更进一步,在一个更大的前瞻性队列中证明exoPD-L1可能是不同疗法的标志物。该研究的首要目标是对黑色素瘤患者血液中的exoPD-L1进行定量分析。次要目标是确定exoPD-L1的量是否与以下因素相关:(i)疾病分期;(ii)对治疗的反应;(iii)总体生存率和无进展生存率;(iv)临床变量;(v)肿瘤中或血浆中游离的PD-L1表达水平。
这里还有一个有意思的发现,肿瘤细胞的上清中检出大量的exoPD-L1而正常细胞上清中exoPD-L1的含量极低。同样地,癌症患者的血液中也检出exoPD-L1,正常人则没有检出。通过生物膜层干涉技术用PD-1重组蛋白捕获外泌体,肿瘤细胞和肿瘤患者血液中均可以捕获到,而非癌细胞上清或正常人血液中无法捕捉到外泌体,说明PD-L1存在于肿瘤产生的外泌体的膜上。
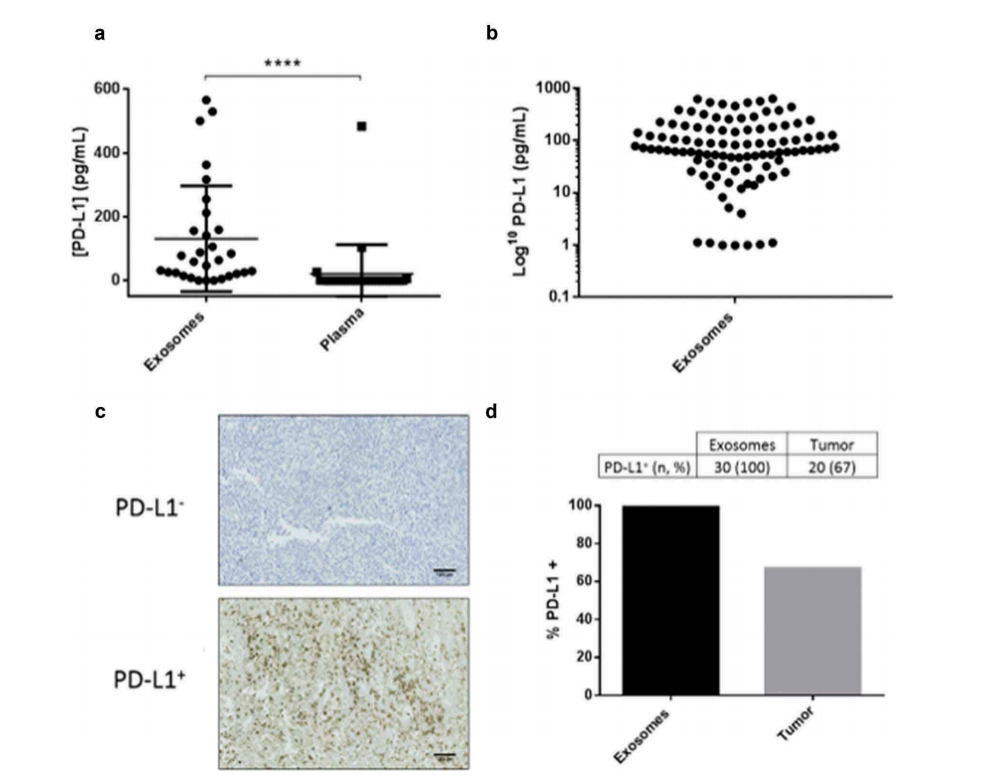
图2.不同来源的PD-L1检测
在黑色素瘤患者的血浆中,外泌体中PD-L1(64.24 pg/mL)的水平远远高于游离的PD-L1(0.1 pg/mL)。不仅如此,exoPD-L1在所有患者的血浆中都有检出,而只有67%的肿瘤活检是PD-L1阳性(图2)。虽然exoPD-L1的基线水平与临床病理特征不相关,治疗前后exoPD-L1的变化(ΔexoPD-L1)与肿瘤对免疫治疗的响应呈现相关性。exoPD-L1的增加与肿瘤发展相关,而降低则与肿瘤消退相关。截止值(阳性判断值)是>100 pg/mL,灵敏度为83%,特异性70%,对于疾病进展的阳性预测值可达91%。该团队目前在主导一个针对黑色素瘤患者的多中心临床研究,期望能够得到关于ΔexoPD-L1更准确的截止值。
ExoPD–L1单颗粒检测
前面介绍的两篇文章都是利用bulk的方法(WB、ELISA等)对群体中大量的exoPD-L1进行半定量或定量的分析,那么这些PD-L1是在外泌体群体中是均匀分布的(每一个外泌体上都表达PD-L1),还是在某些亚群中富集呢?这就需要一个快速、灵敏的单颗粒检测方法在单个外泌体水平进行精细的表征。早期的推文已经详细介绍过,NanoFCM(纳米流式)可在单颗粒水平对外泌体的粒径分布、颗粒浓度、核酸、蛋白等化学性质进行综合分析:做外泌体,我的纯化方法靠谱吗?如何质控?接下来就为大家介绍一下NanoFCM如何评估免疫疗法的标志物。
ExoPD-L1的不同表达水平,会影响抗体药物的治疗效果,故对肿瘤外泌体进行单颗粒水平的精细分析是极有必要的,NanoFCM可在单颗粒水平提供更加精细的结果。如下图,在未经药物作用时,细胞上清exoPD-L1阳性比例为10%左右,而在药物作用后,exoPD-L1水平明显升高(约40%),证明药物作用会影响外泌体尤其是exoPD-L1的分泌,同时exoPD-L1阳性的外泌体分成两个群落,且药物作用后exoPD-L1更多地集中在小粒径范围内(图3)。ExoPD-L1的颗粒浓度、粒径和功能到底存在着怎样的关系呢?这道神秘的面纱还需要通过设计更多严谨的实验来揭开。
NanoFCM在药物刺激前后可观测的指标:
- 细胞上清种外泌体的粒径分布和颗粒浓度变化情况;
- 阳性exoPD-L1的粒径分布和颗粒浓度变化;
- 不同粒径范围内,exoPD-L1的表达强度变化情况;
- 单个外泌体上PD-L1的拷贝数对免疫治疗效果的影响;
- 揭示exoPD-L1粒径和功能的关系。
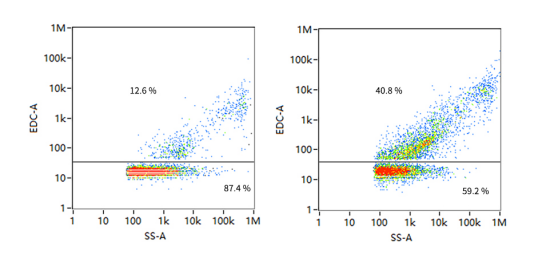
图3.药物作用前后exoPD-L1水平变化
总结与展望
由于免疫疗法的加持,美国黑色素瘤患者的五年生存率已经超过90%,而外泌体PD-L1与免疫疗法关系的新发现,对于黑色素瘤治疗领域来说,又是一个巨大的里程碑。非常期待这个黑色素瘤SPORE项目以及相关文章的发表能够带动更多的研究资源到外泌体PD-L1以及免疫治疗效果的研究,给更多的患者带去希望。
我们知道,目前市面上针对其他类型癌症的免疫疗法总体效率更低,只有10-30%。那其他癌症类型与exoPD-L1的相关性研究有什么发现呢?除了exoPD-L1以外,外泌体表面还存在其他类型的免疫调节分子,如TIM-3,CD73/39,Galectin-9等,这些免疫调节分子对免疫治疗会如何响应?这些问题,我们留到下一篇推文来讨论。
1.关于NCI:美国国家癌症研究所(National Cancer Institute, NCI)是联邦政府进行癌症研究和培训的主要机构,该机构大约由3500人组成,是美国国立卫生研究院(NIH)的一部分,组成美国卫生和公共服务部(HHS)的11个机构之一,也是癌症研究的国家领导者。NCI在全国范围内引导、执行,并且支持癌症研究,以推进科学知识,帮助所有人更长寿、更健康。
About NCI – Overview and Mission – National Cancer Institute
2.关于SPORE:优秀专科研究项目(Specialized Program of Research Excellence, SPORE)是1992年美国国家癌症研究所设立的一个专项基金,也是NCI努力促进合作、跨学科转化癌症研究的重要组成部分。SPORE项目需要基础和临床/应用科学家共同努力,并支持能够开发预防、早期发现、诊断和治疗癌症的新的和多样性的方法的项目。每个SPORE项目会集中关注一种特定的器官,如乳腺癌或肺癌,或者一系列高度相关的癌症,如胃肠道癌症。SPORE项目的目的是使基础科学发现能够快速有效地进入临床,并确定在癌症患者或癌症高风险人群中进行筛查的生物学基础。SPORE基金使得研究者能够开发不仅仅是治疗癌症,并且能够改善患者预后的创新疗法。
Translational Research Program (TRP) (cancer.gov)
参考资料
2.Chen G, Huang A C, Zhang W, et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response[J]. Nature, 2018, 560(7718): 382-386.
3.Cordonnier M, Nardin C, Chanteloup G, et al. Tracking the evolution of circulating exosomal-PD-L1 to monitor melanoma patients[J]. Journal of extracellular vesicles, 2020, 9(1): 1710899.



