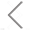牛奶外泌体
Author: Mika Huang Date: February 15, 2023
细胞外囊泡(extracellular vesicles, EVs)作为天然的药物递送载体表现出了独特的优势,但其药物装载效率低下仍是目前亟待解决的一个问题。受脂质体纳米药物活性载药策略的启发,作者报道了一种名为“Sonication and Extrusion-assisted Active Loading”(SEAL)的方法,用于高效和稳定的EVs药物包装。以阿霉素负载的牛奶衍生EVs(Dox-mEVs)为模型,结合超声/挤出技术暂时渗透EVs膜,促进硫酸铵溶液流入管腔,建立主动装载所必需的跨膜离子梯度。与被动装载相比,SEAL的药物包封效率提高了约10倍。针对传统的包封率测定无法揭示EVs装载异质性,难以准确评估载药效率的问题,该研究利用了NanoFCM这一单颗粒水平纳米分析利器对Dox-mEVs进行了粒径分布、颗粒浓度及装载效率的测定,并结合脂膜荧光标记和免疫荧光染色等方法进行多参数表征,快速优化分离纯化策略提高载药囊泡颗粒的比例。最终,通过细胞实验进一步阐明了药物分子装载效率及载药囊泡颗粒纯度对mEVs药物递送能力的影响。文中提出的SEAL载药方法及基于NanoFCM的载药效率表征策略能够为EVs的工程化应用及评估提供借鉴。
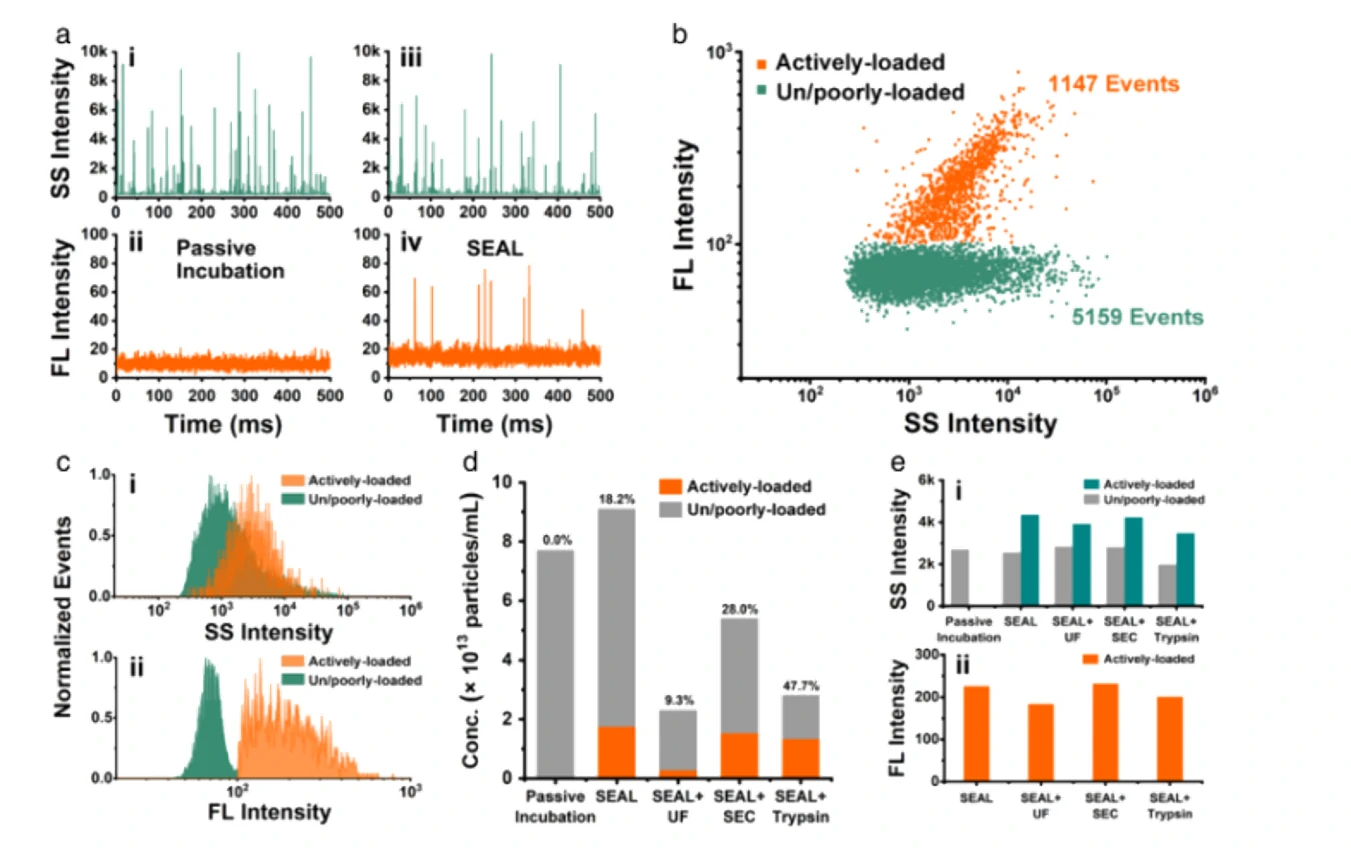
图1. Dox-mEVs的载药效率
图2. 磁珠法提高主动载药囊泡颗粒比例
应用NanoFCM对牛奶外泌体载药的情况进行多参数的综合分析,评估药物装载效率并逐步进行优化,基于NanoFCM的载药效率表征策略可以为EVs的工程化应用提供参考。
J Extracell Vesicles, 2021, 10:e12163.