牛津大学Nature子刊揭示T细胞突触囊泡研究新方法
Author: Mika Huang Date: August 30, 2022
在过去的10年里,人们发现一些超分子效应物会在细胞-细胞连接的界面上传递信息。免疫突触(immunological synapse)是抗原递呈细胞(antigen-presenting cell, APC)和T细胞相互作用的过程中,在细胞与细胞接触部位形成的一个特殊结构,是促进抗原、共刺激/共抑制、细胞因子三种激活信号从抗原递呈细胞传递到T细胞的分子枢纽。在与抗原呈递细胞作用过程中,T细胞会释放第四类信号—跨突触囊泡(trans-synaptic vesicles, tSV),介导免疫细胞之间的双向通信,但是它们作用的具体方式和原理仍不清楚。
近日来自牛津大学的Michael L. Dustin教授在Nature Communications上发表题为“T-cell trans-synaptic vesicles are distinct and carry greater effector content than constitutive extracellular vesicles”的文章,开创性地提出了脂质双分子层珠子(Glass Bead Supported Lipid Bilayers, BSLB)作为一种多功能的合成APCs来捕获、表征tSV,为研究tSV提供了一种新的检测手段。该研究发现与细胞外囊泡(EVs)相比,tSV中有更多的RNA结合蛋白和更高含量的microRNA,验证了tSV作为细胞间信使的特殊作用。

文章首先通过BSLB模拟APC呈递细胞,研究与T细胞相互作用过程中tSV的转移和释放。T细胞-BSLB共培养物的延时成像显示,BSLB可促进来自受刺激T细胞的CD40L的转移,这在被转移的tSV组成的BSLB上留下了突触印记(图1-a)

图1. BLBS原理
进一步,作者将BSLB上的tSV洗脱下来,并利用NanoFCM对tSV和细胞上清获得的EVs进行综合表征和对比。发现tSV颗粒大小在82.13± 0.75nm,而EVs的粒径为65± 25nm,明显小于tSV的粒径大小。用NanoFCM的Exo粒径标准品(含68, 91, 113, 155 nm四种尺寸的SiO2球),对EVs和tSV的粒径进行分群,发现与EVs相比,tSV中大于113nm和155nm的颗粒所占比例更高(图2-d);tSV中TCR、CD40L、CD81阳性的tSV颗粒粒径显著大于对应的EVs阳性的颗粒(图2-e)。

图2. tSV和EVs颗粒大小亚群分类
进一步地,对tSV和EVs进行CD81和TCRαβ双标,发现tSV中两种标志物双阳的比例高于EVs,且TCR阳性的tSV粒径也显著大于TCR阳性的EVs(图3)。后续作者研究发现不同种类的T细胞来源的tSV内容物具有明显区别;tSV比EV携带更多的RNA结合蛋白和特有的microRNA等,感兴趣的读者可以阅读原文进行了解。总的来说作者提出了珠状脂质双分子层(BSLB)作为一种多功能的合成APCs来捕获、表征和促进对tSV生物发生的理解,开发了一种免疫细胞间信息传递和交流研究的新方法。
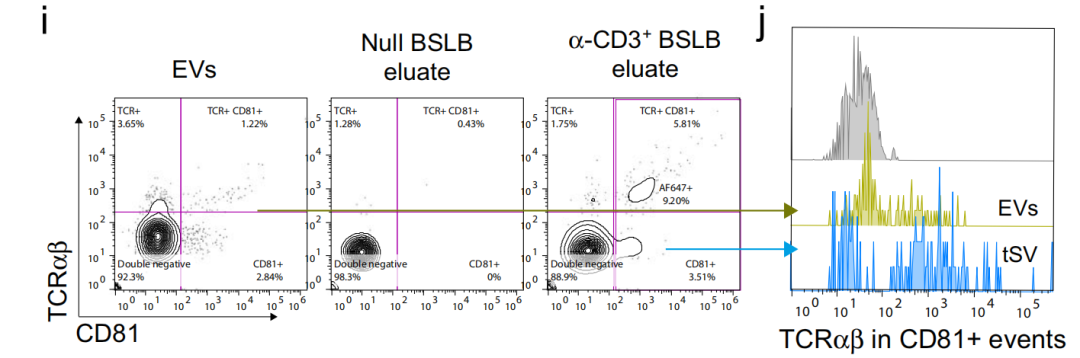

图3. tSV和EVs功能亚群分析
文章中利用NanoFCM对tSV和EVs的亚群进行精细分类,根据颗粒的大小将tSV和EVs分成四个不同大小的亚群,通过抗体标记,可对tSV和EVs 功能亚群进一步精细研究。利用NanoFCM单颗粒水平和超高分辨率的优势,可对tSV的不同亚群进行精细分类和研究,有望加快研究者对tSV的精细化研究进程!
参考文献
1.Céspedes P F, Jainarayanan A, Fernández-Messina L, et al. T-cell trans-synaptic vesicles are distinct and carry greater effector content than constitutive extracellular vesicles[J]. Nature communications, 2022, 13(1): 3460



