红细胞来源外泌体靶向治疗白血病
Author: Mika Huang Date: February 15, 2023
急性髓系白血病(Acute Myeloid Leukaemia, AML)是最高发的一种成人血癌。虽然 2/3 的AML患者经化疗和靶向治疗后能达到完全缓解,但是高达60% – 65%的年轻成人患者会在三年内复发,致使生存率急剧下降。治疗性的寡核苷酸(ASO)可高特异性地与癌基因结合,并使其沉默,是一种极具前景的AML治疗策略。然而,目前可安全、有效递送ASO的方法还相对匮乏。细胞外囊泡(EVs)作为新一代的递送工具,在解决ASO递送难题中极具潜力。然而由于产量的限制,基于EV的药物递送方法尚处在早期阶段。血细胞是非常理想的EVs来源。在细胞体外培养体系中,细胞密度通常为~1E+6 cells/mL,但人血液中的红细胞(red blood cells, RBC)浓度就可高达5E+6 cells/μL。因此,RBCs来源的EVs(RBCEVs)在作为递送载体时具有其天然优势。在这项研究中,作者将外泌体进行工程化载药和修饰,并利用纳米流式检测技术对修饰后的外泌体进行表征。
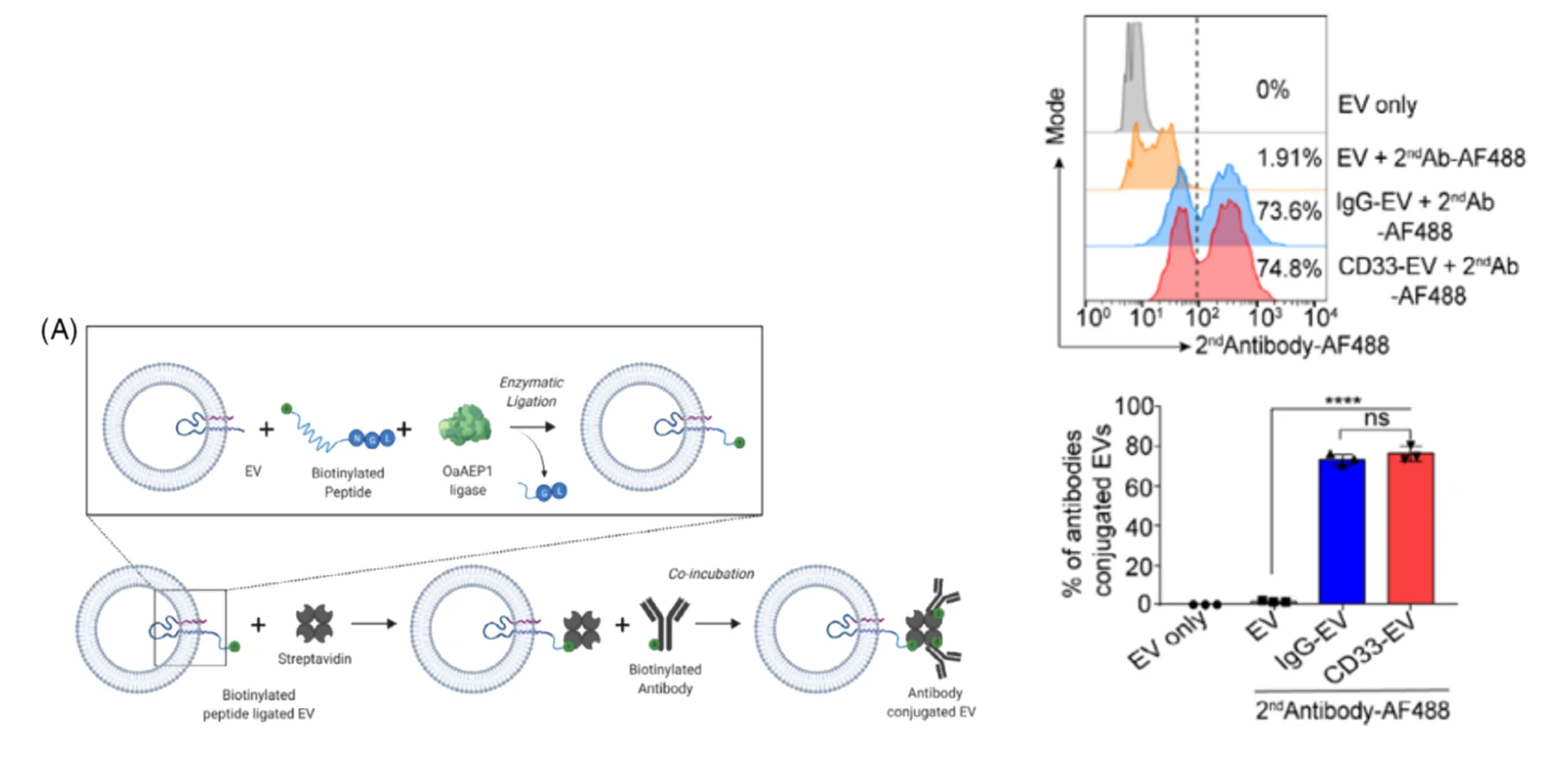
图1. EVs表面靶向抗体修饰策略 图2. NanoFCM评估EVs靶向抗体修饰效果
利用NanoFCM对该靶向抗体的修饰结果进行了定性表征和定量分析,结果表明高达74.8%的EVs表面成功修饰了CD33抗体,且73.6%的EVs修饰了同型对照IgG,二者没有显著差异,可以用于下游的对比试验。后续的体内实验证明装载了ASO的RBCEVs可以显著抑制白血病的进展。纳米流式检测技术在外泌体修饰结果的验证方面起到了非常关键的作用,有望推动工程化外泌体药物的发展。
Cell Prolif., 2022, 55(9):e13255.