线上讲座|核酸药物—纳米递送系统质控研究策略
Author: Mika Huang Date: April 24, 2022
核酸药物被认为是继小分子药物、抗体药物之后的第三次新药浪潮,且新冠疫情的助推作用,使得核酸药物快速进入发展的快车道,深受医药企业和资本青睐。预计全球纳米药物市场在2027年将达到827亿美元。
主流的核酸药物主要包括反义寡核苷酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)等,核酸药物进入细胞面临两大挑战,一个是RNA暴露在血液中容易被血浆和组织中的RNase降解,而且会引发不必要的免疫反应;另一个是带负电的RNA难以跨膜进入胞内,所以需要一个递送系统将它们传送到细胞中行使功能。
递送平台的开发是整个核酸疗法产业链条的重点,也是核酸疗法获得成功的必要条件。目前,学术界和工业界开发了多种用于mRNA递送的材料,如脂质纳米颗粒(LNPs)、脂质体、脂质复合物、外泌体、高分子聚合物、多肽等(下图1)。其中,脂质纳米颗粒应用最为广泛,为核酸药物的快速发展奠定了坚实的基础,被用于临床递送小分子、寡核苷酸、siRNA药物以及mRNA等。值得指出的是,全球首个获批上市的RNAi药物patisiran(商品名Onpattro)使用脂质纳米颗粒递送siRNA;两款获批的mRNA疫苗,mRNA-1273和BNT162b也都使用脂质纳米颗粒来递送mRNA。许多其他的脂质纳米颗粒RNA剂型正在临床评估中,用于预防和治疗病毒感染、癌症、遗传疾病以及免疫疾病等多种疾病类型。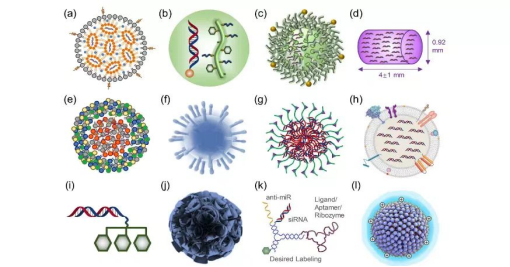
图1. 常用的核酸药物纳米递送系统[1]
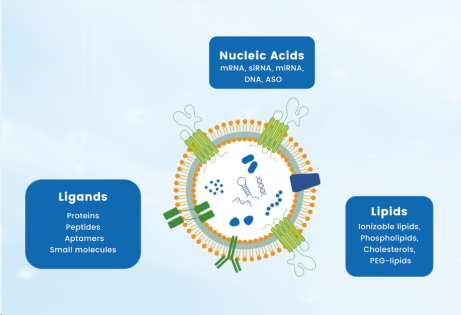
图2. 递送系统结构图
另一方面,核酸药物表面配体的修饰将影响药物的免疫逃逸、肿瘤渗透和扩散、细胞靶向和内化效率因素等,通过修饰细胞特异性靶向的配体将递送系统进一步功能化,表面配体的类型通常有抗体、靶向肽、核酸适配体以及小分子等(上图2),如何实现对纳米药物的靶向修饰的快速、准确定量表征一直是一项亟待解决的问题。
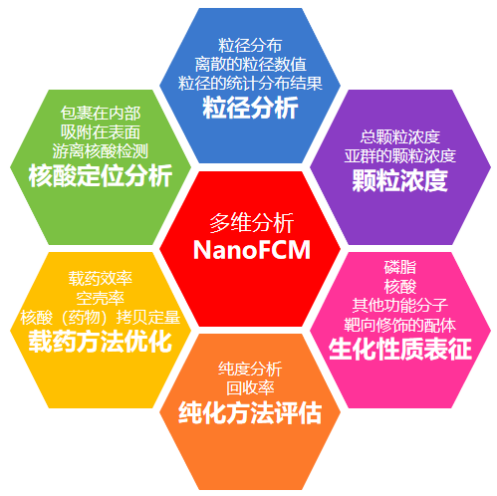
核酸药物在体内的行为由其各种理化性质决定,除了以上提到的靶向修饰快速准确定量,还包括载体的组成和性质、粒径及分布、结构及形貌、表面电荷、亲疏水性、颗粒浓度、载药量、载药比例等指标。对这些理化性质进行快速准确的表征有助于核酸药物载体的选择、药物设计、研发及质量控制,实现核酸药物研发、CMC工艺开发及生产过程的快速质控并指导工艺优化。
核酸疗法的研发经历了漫长的发展历程,化学修饰和递送系统等关键技术的突破在核酸药物产业化中发挥了重要的作用。通过选择更加优异的药物递送载体以及采用靶向修饰等策略,核酸药物这种超级药物将引领创新药进入新时代。
纳米流式检测技术能够提供快速高通量且多维度的单颗粒核酸药物检测,本次NanoFCM携手博迈思,特邀NanoFCM应用总监马玲博士带来《核酸药物——纳米递送系统质控研究策略》,将围绕纳米流式检测技术在核酸药物多维度表征中的应用进行阐述,助力核酸药物研发、CMC工艺开发及生产质控。

参会方式
1.时间:
2022年4月26日 19:00-20:00 星期二
2.参会方式:
①复制下方链接至浏览器打开进入课堂
https://gjy.h5.xeknow.com/sl/xik22
②扫描下方二维码进入课堂
主讲人简介
马玲 博士,厦门大学化学生物学系和美国爱荷华州立大学联合培养博士,2016年毕业后加入厦门福流生物科技有限公司创始团队。主要从事生化分析与生物传感研究,致力于发展先进的生物纳米颗粒(外泌体、病毒、纳米药物及细菌等)的表征技术和方法,拥有化学、生物等多学科交叉的学术背景。在Angew. Chem. Int. Ed., ACS Nano, Anal, Chem., Biosens & Bioelectron.等国际化学主流期刊发表多篇SCI论文,2018年作为团队成员入选第六批省引才“百人计划”,2020年团队项目获得厦门市科技进步一等奖。
纳米流式检测仪
纳米流式检测仪可在单颗粒水平,对7-1000 nm的颗粒进行综合表征。基于散射光和荧光信号的多参数检测建立了核酸纳米药物的粒径分布、颗粒浓度、载药比例、载药量以及核酸定位分析的定量表征方法,可对核酸纳米药物的生产过程进行质量控制,优化生产条件、提高载药效率。纳米流式检测仪的应用贯穿整个药物研发、生产、质控、稳定性评估等整个过程,为核酸纳米药物的研发和质量控制提供重要的技术保障,这将极大加快核酸疗法的基础研究和临床转化进程。