分离纯化方法评估
细胞外囊泡(extracellular vesicles, EVs)具有多种生物学功能,可参与机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等,在多种疾病和生理过程中扮演重要的角色。限制EVs发展的挑战之一是缺乏公认的EVs分离的有效方法。在这项研究中,作者选取血浆、细胞上清、尿液三种典型样本作为EVs的来源,对比超速离心(UC)、沉淀(Precipitation)、尺寸排阻加超滤(SEC+UF)、微流控(Exodisc)等纯化方法,通过纳米流式检测技术对分离的EVs进行得率、纯度、表面蛋白表达分析综合评估它们的纯化效果,最后基于样本类型和下游应用,对分离纯化方法的选择提出了切实可行的建议。
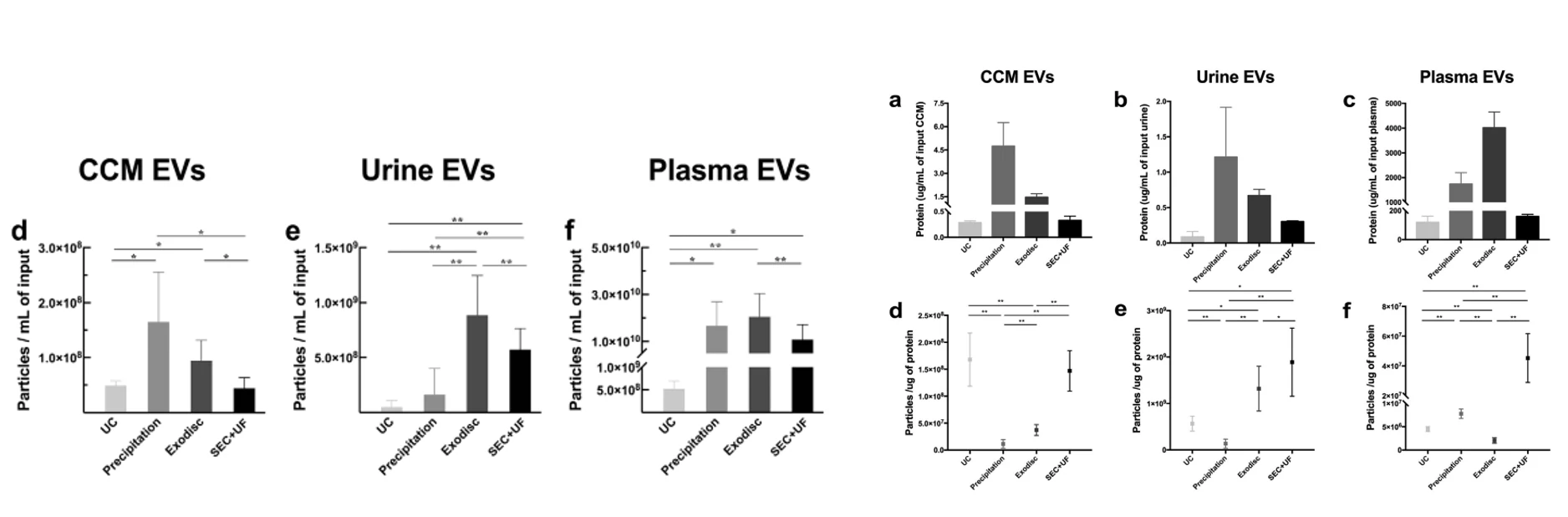
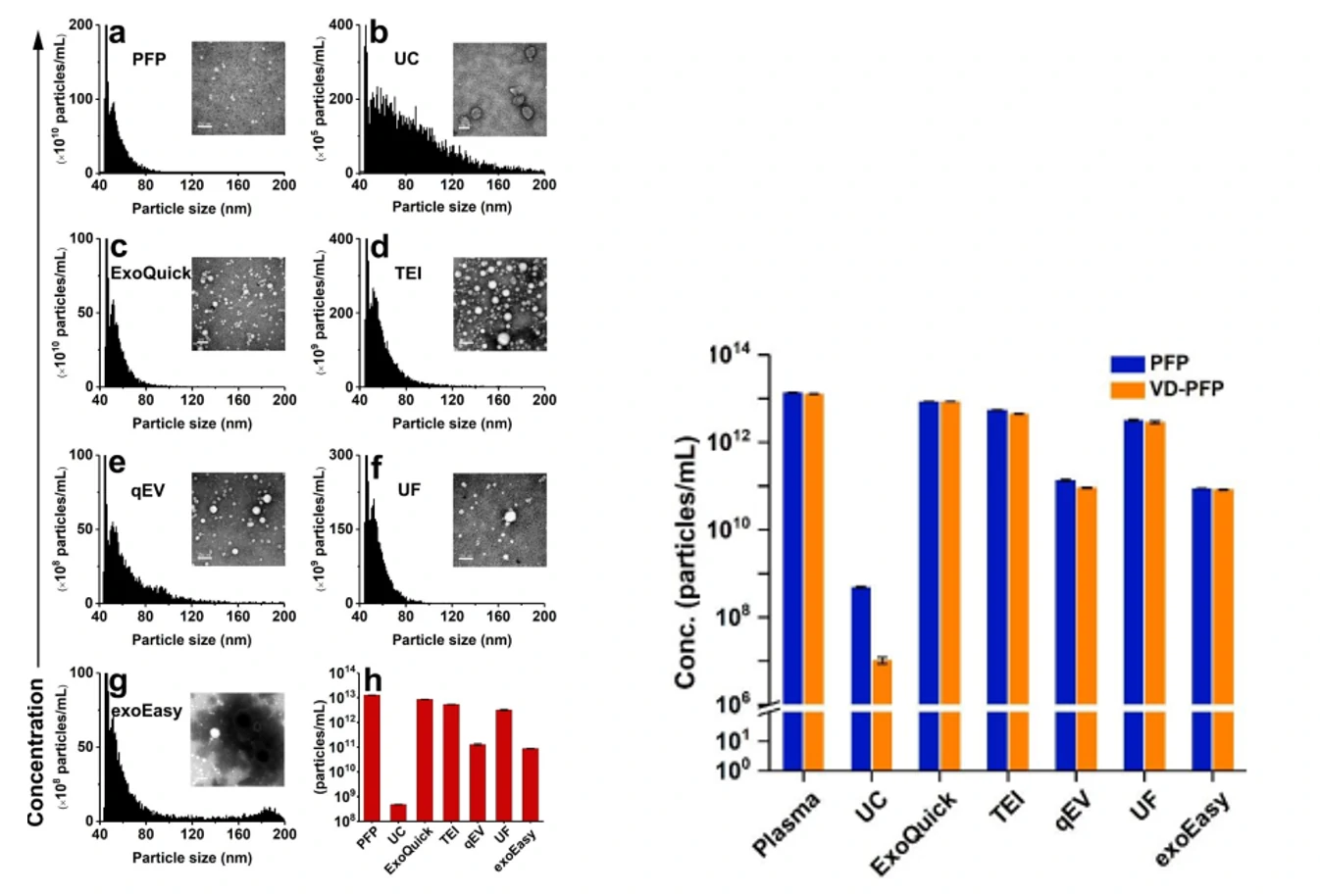
图1. 不同纯化方法获得的EVs颗粒浓度 图2. EVs颗粒蛋白比(纯度)分析
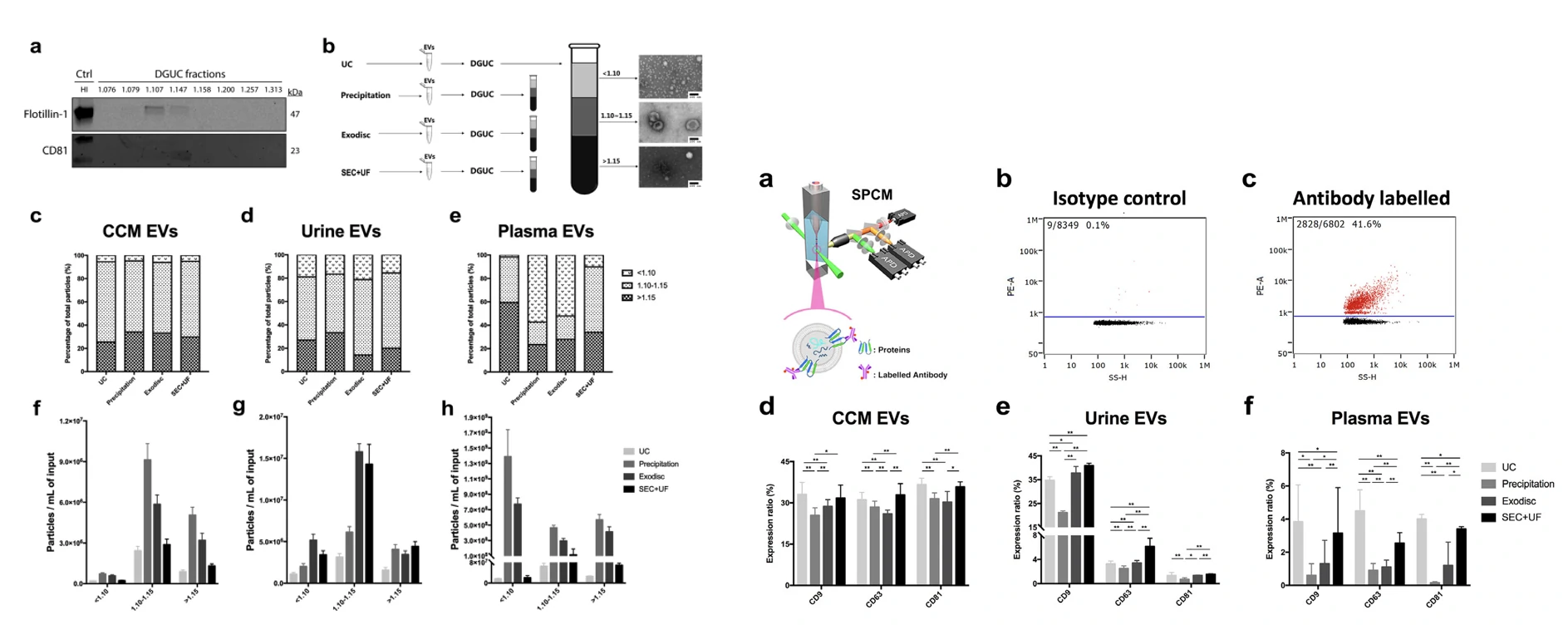
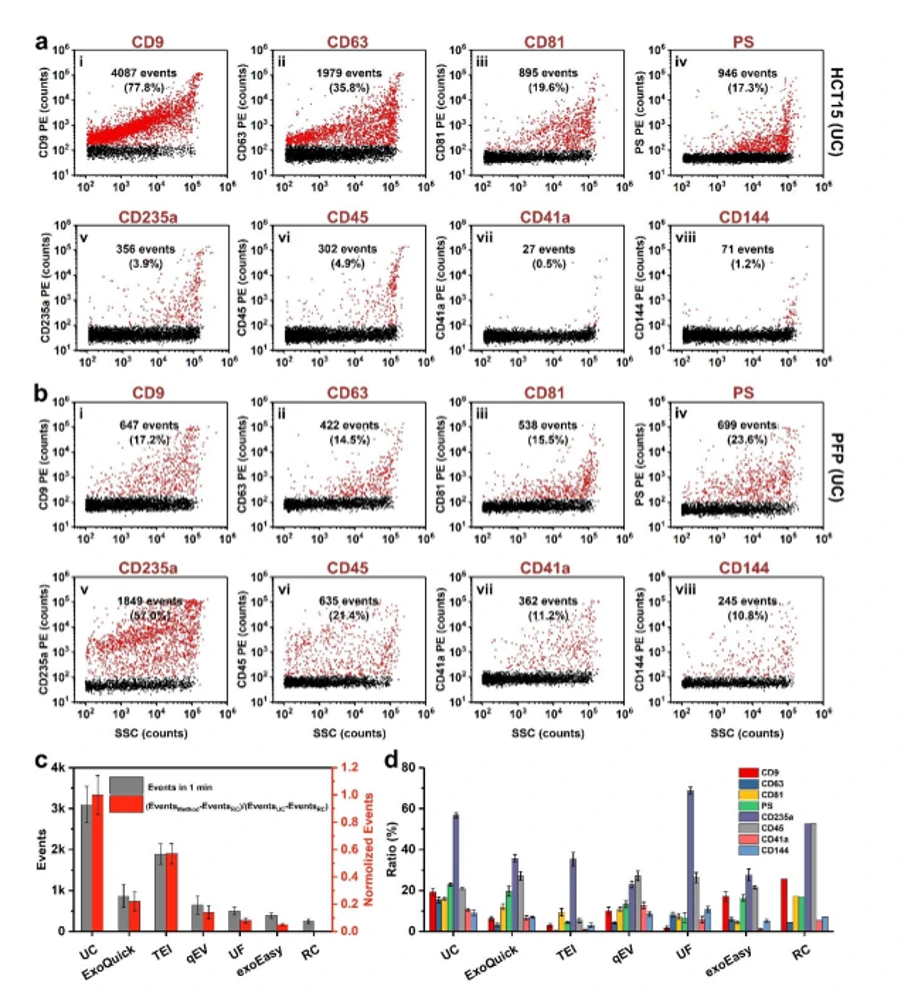
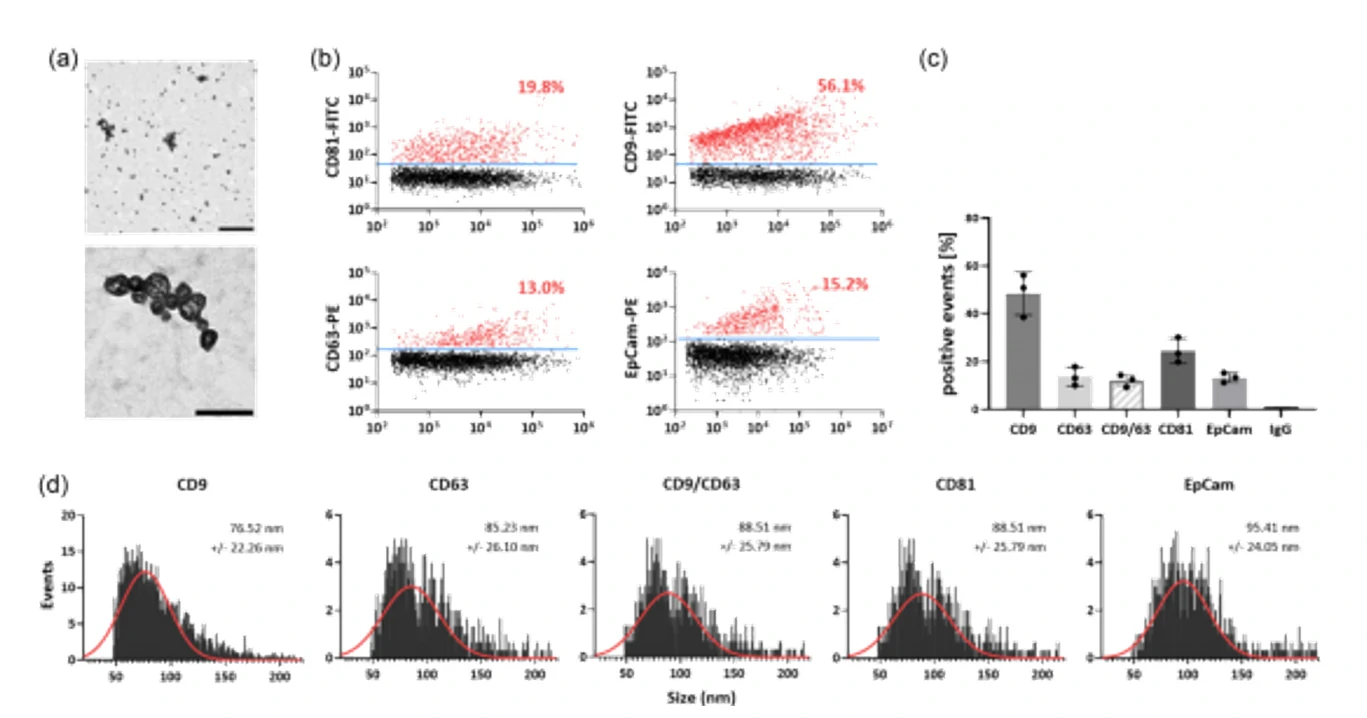
图3. 密度梯度离心分析EVs纯度图 图4. EVs表面蛋白标志物分析
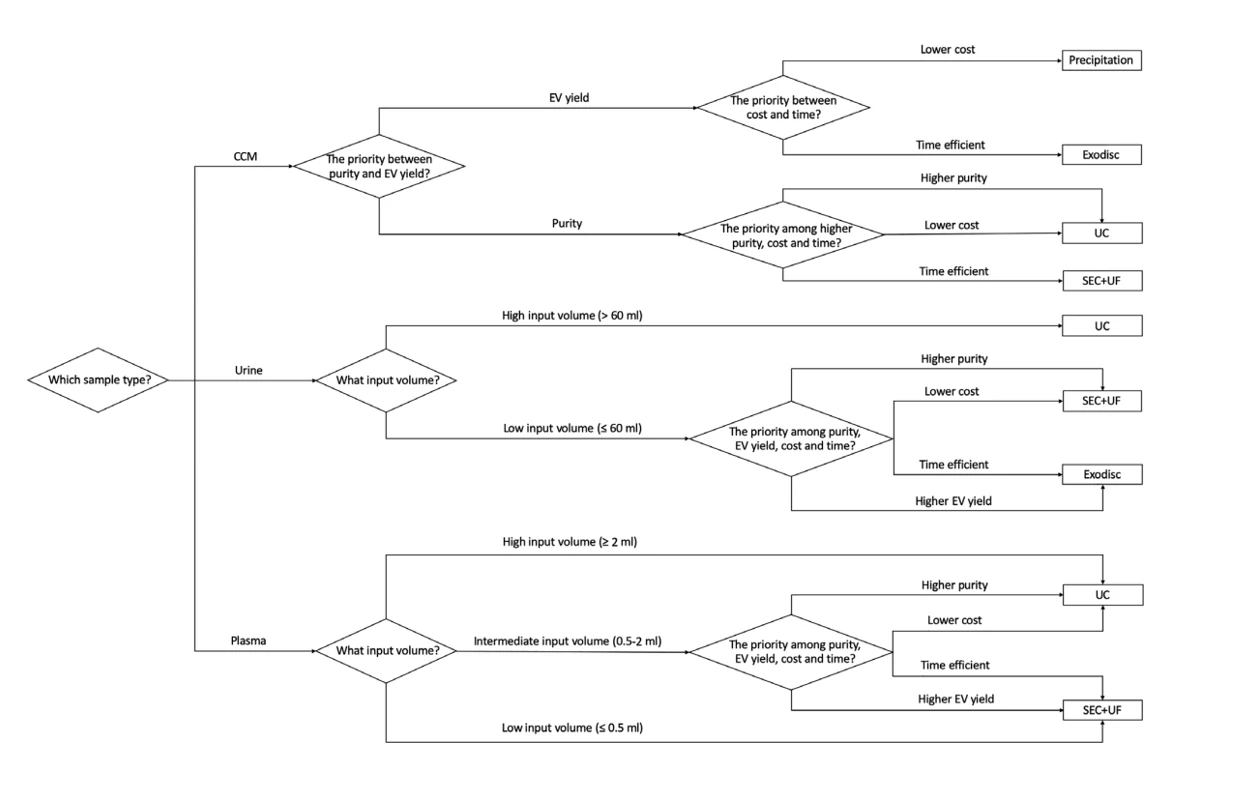
图5. 基于样本来源和下游应用选择合适的EVs分离方法
该研究中,作者通过纳米流式检测技术对EVs进行多参数的表征,评估适合不同样本类型的纯化方法,总结出基于样本来源和下游应用的不同选择适合的纯化方法的结论,并提供了切实可行的建议。
J Extracell Vesicles, 2020, 10(2):e12044.