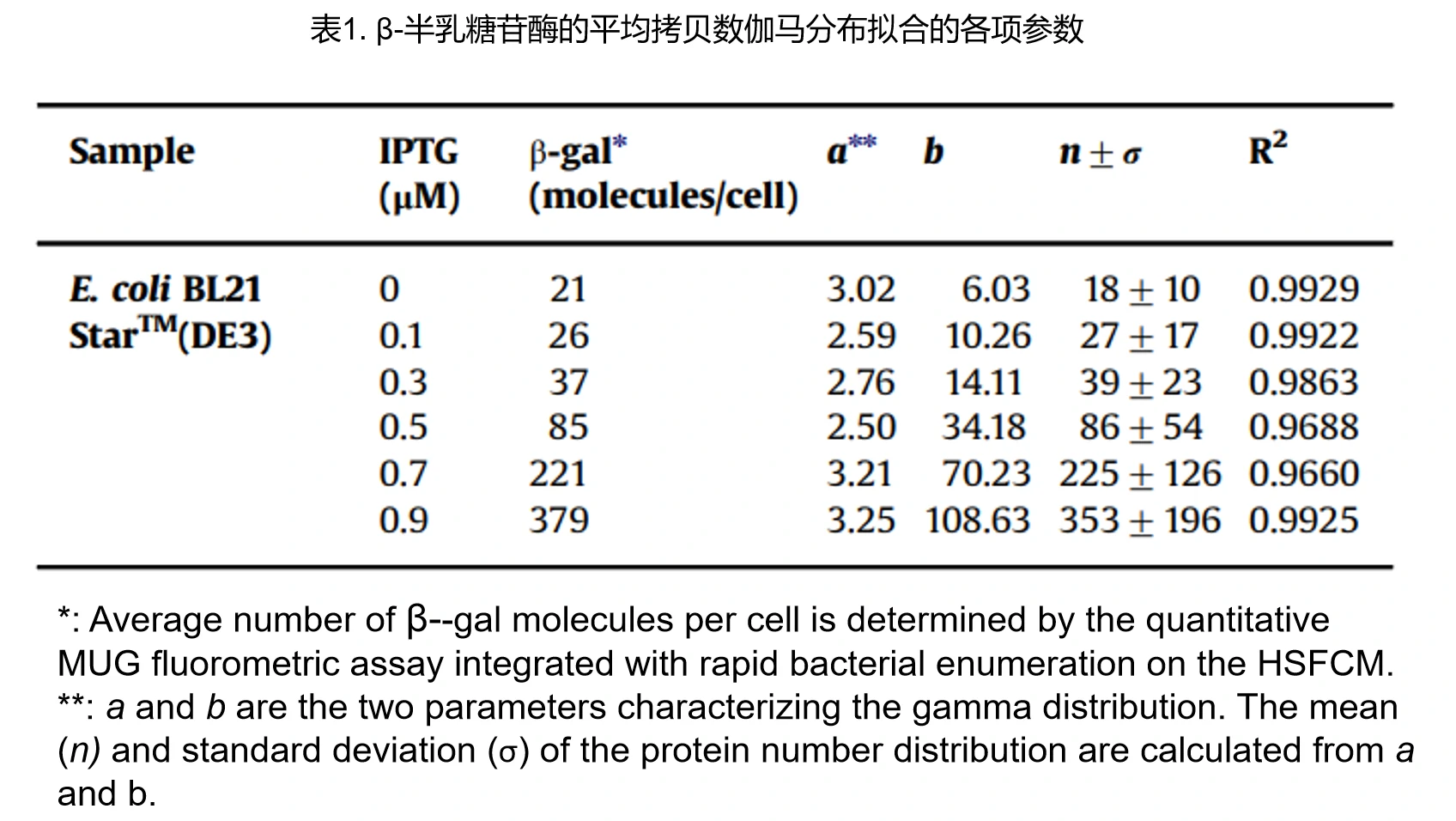
单个细菌自发荧光的检测与定量
Author: Mika Huang Date: February 21, 2023
细菌在可见光区的自发荧光会掩盖低拷贝荧光标记分子或者低丰度荧光蛋白所产生的微弱荧光信号,从而影响荧光显微镜成像和流式细胞仪检测。另一方面,自发荧光的检测也能够为细菌的鉴别提供一定的理论依据。细菌的自发荧光信号主要来源于细菌中氧化型的核黄素类物质(NADH、NADPH、FAD等),它们的最大吸收波长位于488 nm附近,发射光谱则与FITC荧光通道的滤光片相匹配。采用几种不同大小且FITC当量已知的荧光纳米颗粒绘制荧光强度和FITC当量的标准工作曲线,继而在单细菌水平对细菌自发荧光进行定量分析。
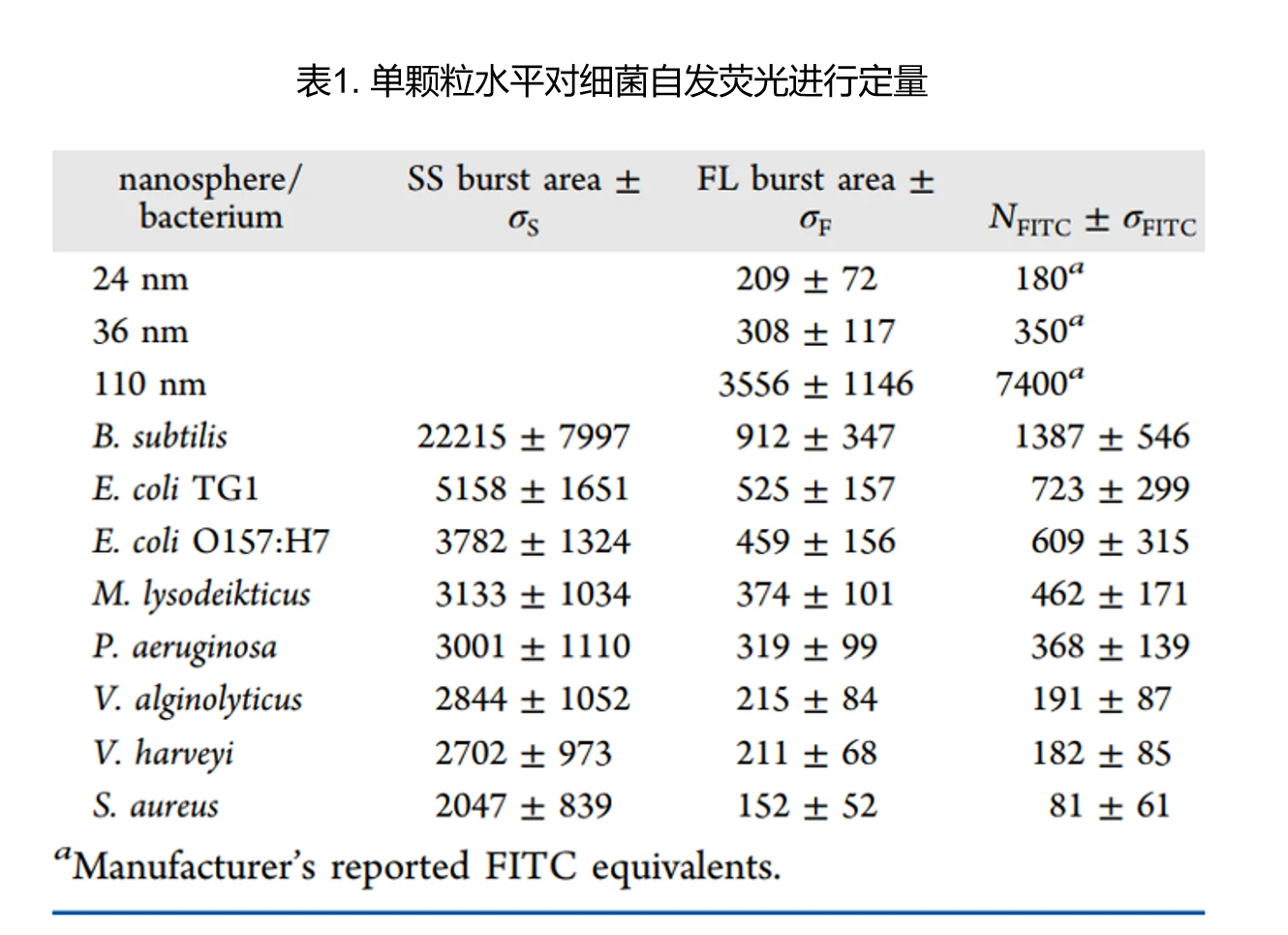
纳米流式检测仪可以检测到单个细菌的自发荧光信号,这些荧光信号主要来源于细菌中氧化型的核黄素类物质。
Anal. Chem., 2012, 84(3), 1526-1532.