六种载药策略对比
Author: Mika Huang Date: February 15, 2023
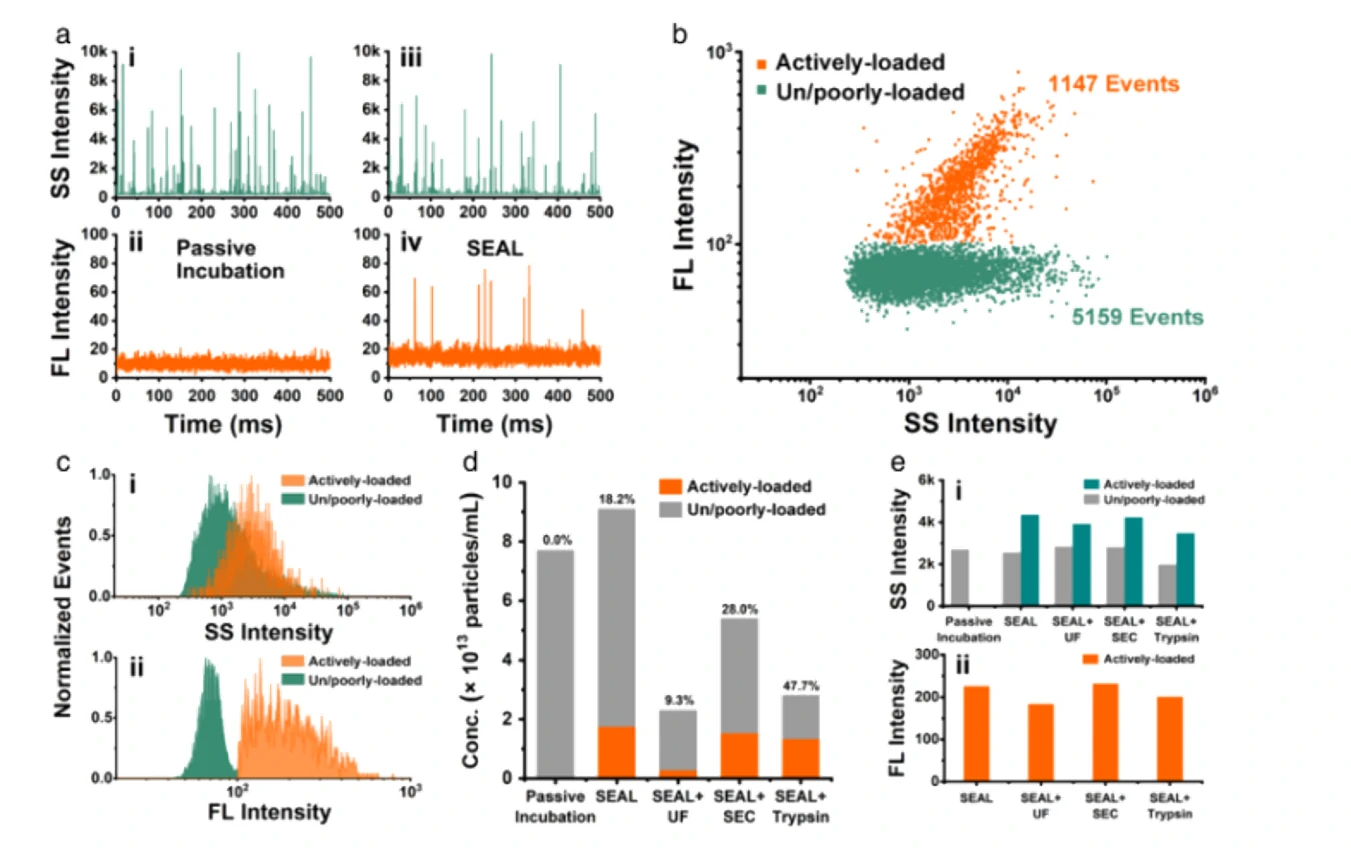
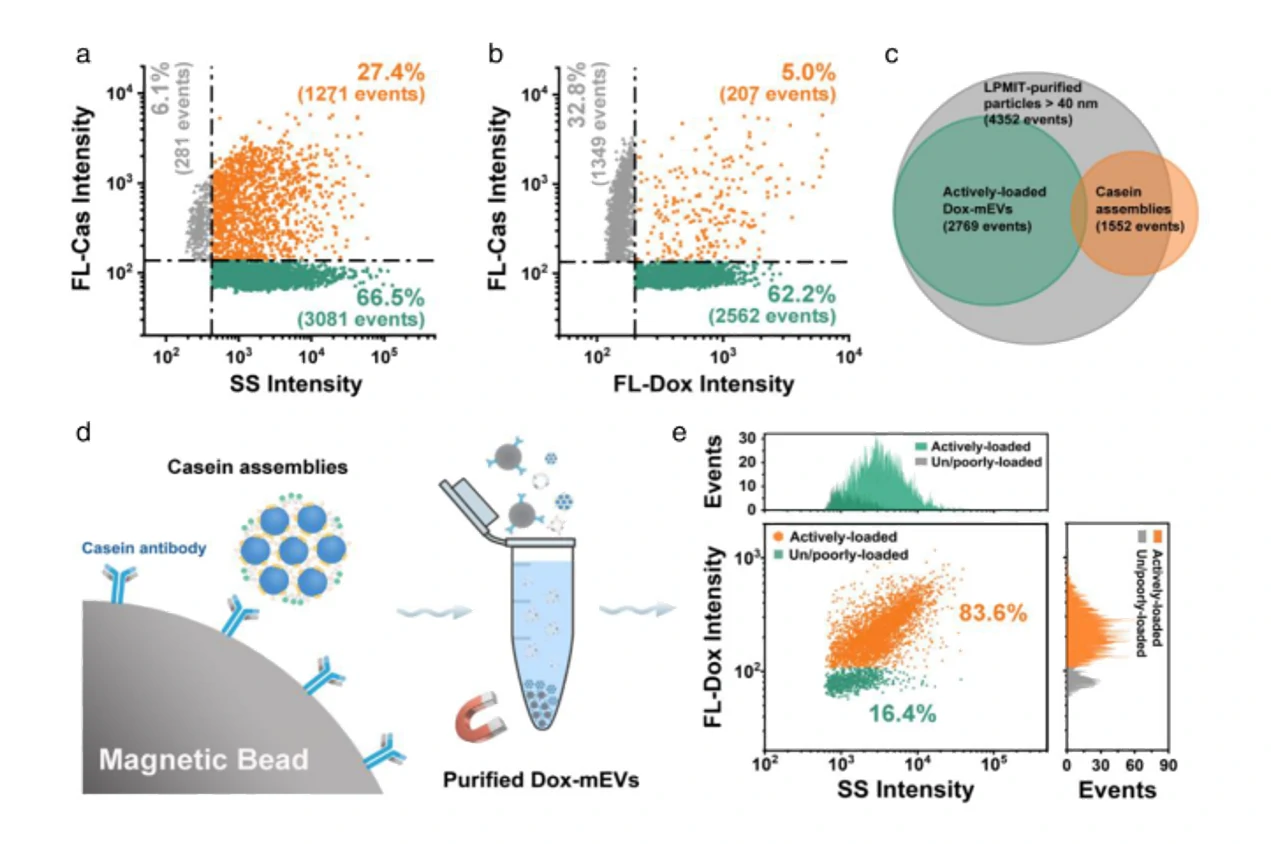
细胞外囊泡因其在细胞间通讯中的天然作用而被视为很有前景的下一代药物递送系统。然而,纳米级的EVs本身具有较大的异质性,迫切需要在包封率的评估之外,对载药后EVs的生物功能改变进行持续的追踪和监控。本研究介绍了以阿霉素(Dox)为模型药物,利用纳米流式检测技术(nFCM)对粒径低至40 nm的单个EVs进行多参数表征,通过在单颗粒水平分析包装效率、EVs浓度、药物含量以及膜蛋白的表达情况,评估共孵育、电穿孔、挤出法、反复冻融、超声和表面活性剂处理等六种常用的载药策略对Dox的装载效果。结果表明共孵育和电穿孔法可以获得更高的装载效率,单颗粒的载药量也更高;通过膜蛋白标记发现挤出法、反复冻融、超声和表面活性剂处理都会不同程度地破坏EVs的结构;共聚焦显微镜和流式细胞术的结果均证实电穿孔的方法获得的EVs更容易诱导细胞凋亡。
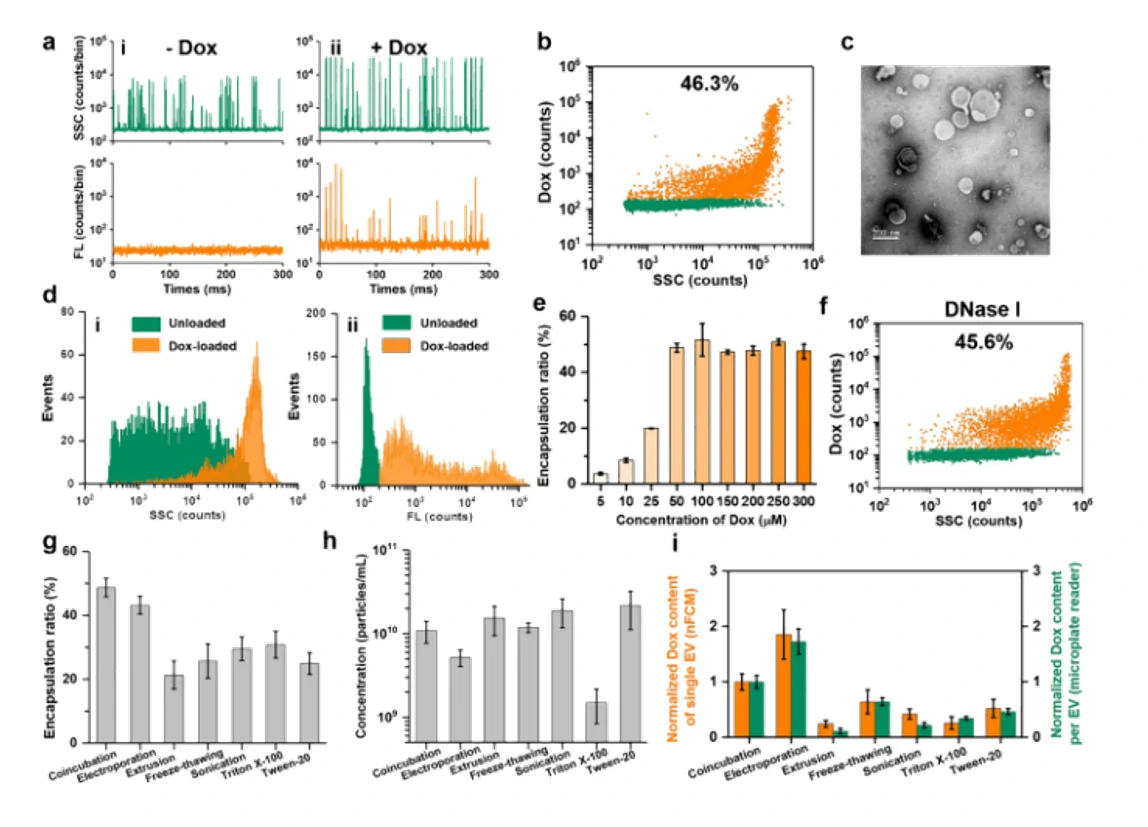
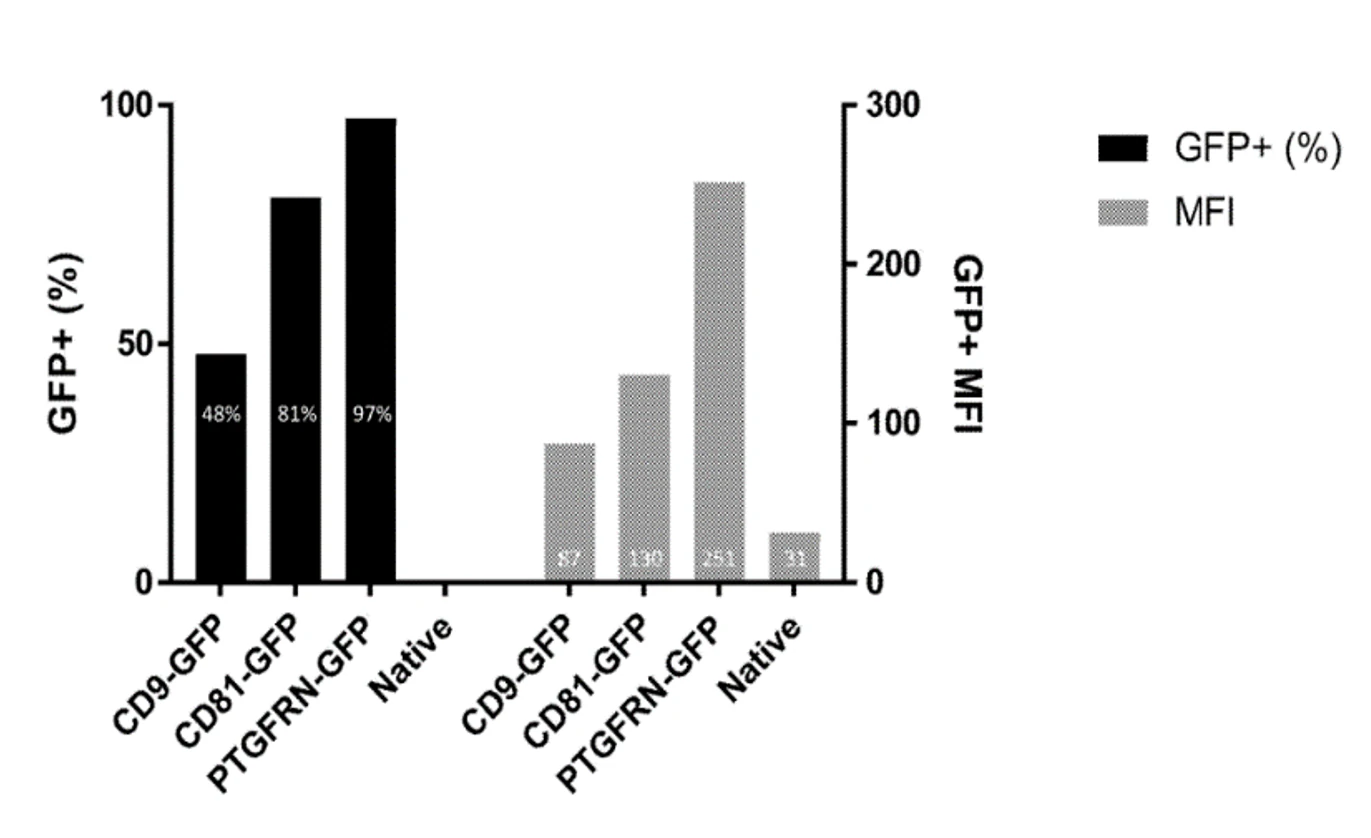
图1. 不同载药策略EVs装载Dox的效率
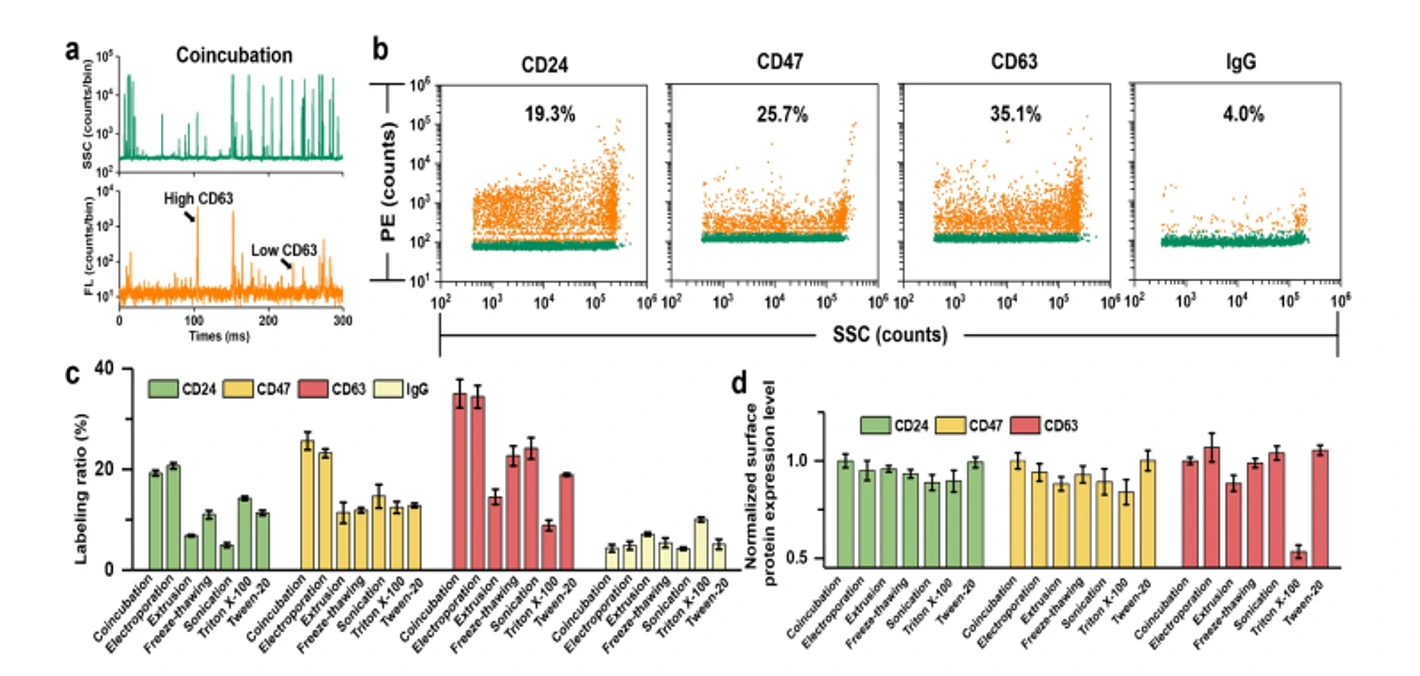
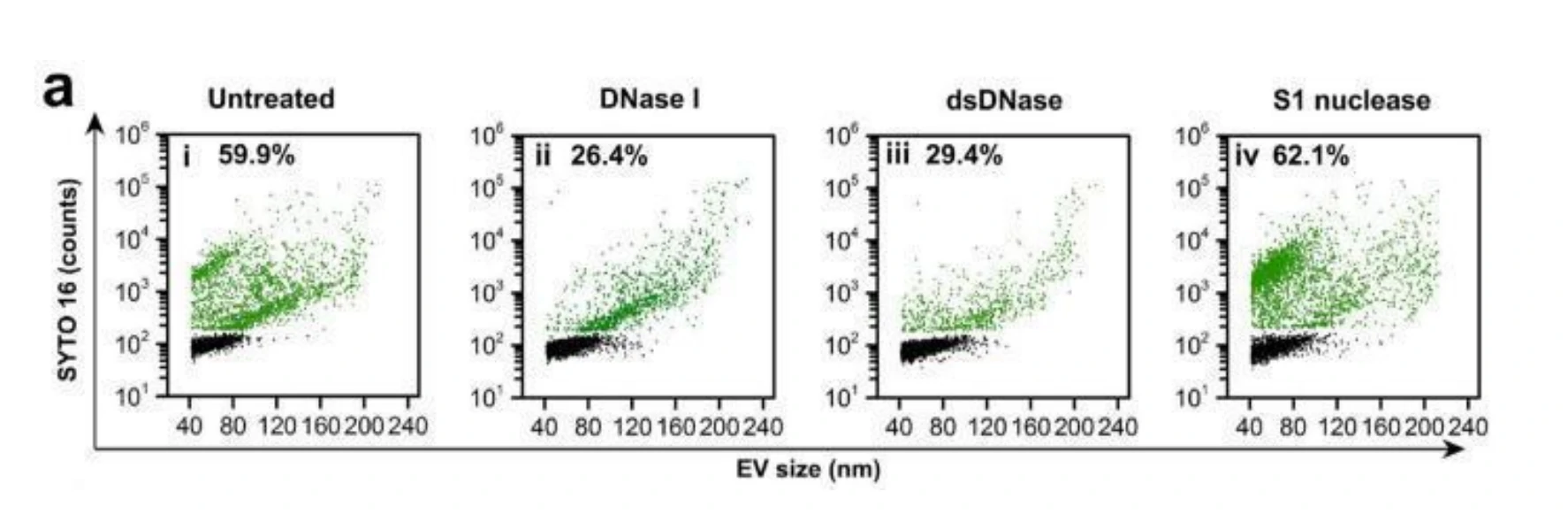
图2. 不同的载药策略制备的Dox-EV膜蛋白的表达情况
结合免疫荧光标记,利用纳米流式检测平台可以实现装载Dox后EVs膜表面蛋白的分析,评估载药策略对EVs表面蛋白的影响。纳米流式检测技术为单颗粒水平评估EV的药物装载策略提供了一个快速、灵敏、通用的平台。
Anal Bioanal Chem., 2022. https://doi.org/10.1007/s00216-022-04248-4.