NanoFCM助力新型抗癌药物研发
Author: Mika Huang Date: June 6, 2021
转移性腹膜癌(Metastatic peritoneal carcinoma,mPC)是一种临床治疗难度大、病人生存期短、死亡率较高的疾病。目前腹腔内高温化疗(HIPEC)是治疗 mPC 的标准方法,但是这种方法存在药物渗透效率低、易产生耐药性等缺点,目前亟需新的治疗手段和方法。
来自中山大学第三附属医院的刘杰团队在Advance Science(IF=15.8)上发表了题为“Thermosensitive Exosome–Liposome Hybrid Nanoparticle-Mediated Chemoimmunotherapy for Improved Treatment of Metastatic Peritoneal Cancer”的论文,作者通过基因纳米技术,合成“脂质体-外泌体”纳米复合颗粒,这种新型纳米药物极大改善了药物传递效率,并且能够显著抑制肿瘤的生长,具有极大的应用价值。
 注射到血液中的抗癌药物或纳米药物有很大一部分会被机体的免疫系统清除,进而影响治疗效果,通过增大药物剂量的方式则通常会引起许多不良反应。CD47是肿瘤免疫治疗领域一个重要的潜在靶点,细胞表面的 CD47 能够与免疫细胞上的受体结合,发出“别吃我”的信号,从而保护细胞不被免疫系统破坏。脂质体是一种医药界公认的纳米药物载体,已广泛用于临床医学研究与疾病治疗,尤其适用于抗肿瘤药物。
注射到血液中的抗癌药物或纳米药物有很大一部分会被机体的免疫系统清除,进而影响治疗效果,通过增大药物剂量的方式则通常会引起许多不良反应。CD47是肿瘤免疫治疗领域一个重要的潜在靶点,细胞表面的 CD47 能够与免疫细胞上的受体结合,发出“别吃我”的信号,从而保护细胞不被免疫系统破坏。脂质体是一种医药界公认的纳米药物载体,已广泛用于临床医学研究与疾病治疗,尤其适用于抗肿瘤药物。
该研究通过基因工程手段在成纤维细胞外泌体上过表达CD47蛋白,获得具有免疫逃逸功能的工程化外泌体(gExos)。同时用热敏脂质体(TLs)装载紫杉醇、GM-CSF等抗癌药物,诱导这两种纳米颗粒发生融合,得到“外泌体-脂质体”融合颗粒(gETL NPs),该颗粒既可以逃避机体的免疫清除,又有效包装了抗癌药物,能够有效抑制肿瘤的发展。
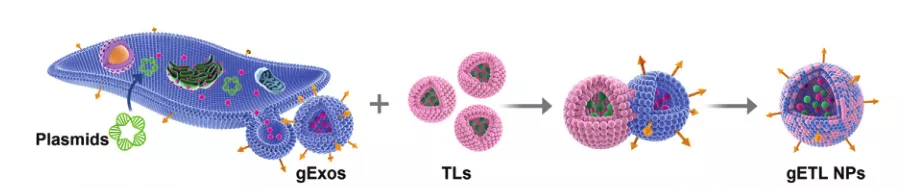 图1. 外泌体-脂质体融合示意图
图1. 外泌体-脂质体融合示意图
文中作者利用 NanoFCM 对脂质体-外泌体融合过程进行监测。首先作者分析了 FITC 标记的脂质体和纯化的外泌体,分别得到阳性颗粒比例和粒径分辨信息;接着通过磁珠富集CD9阳性的外泌体,加入脂质体诱导二者发生膜融合,用NanoFCM测定经磁珠富集的脂质体-外泌体混合颗粒,FITC阳性颗粒的比例高达95.7%,证明脂质体和外泌体发生融合(图2);另外,作者分析了外泌体-脂质体融合纳米颗粒 CD47 的表达比例,与未改造的 ETL NPs(5.36%) 相比,经基因改造后的 gETLNPs 表面CD47 的表达比例高达 56.84%,可有效避免纳米药物被机体免疫系统清除,延长药物作用时间,提升治疗效果(图3)。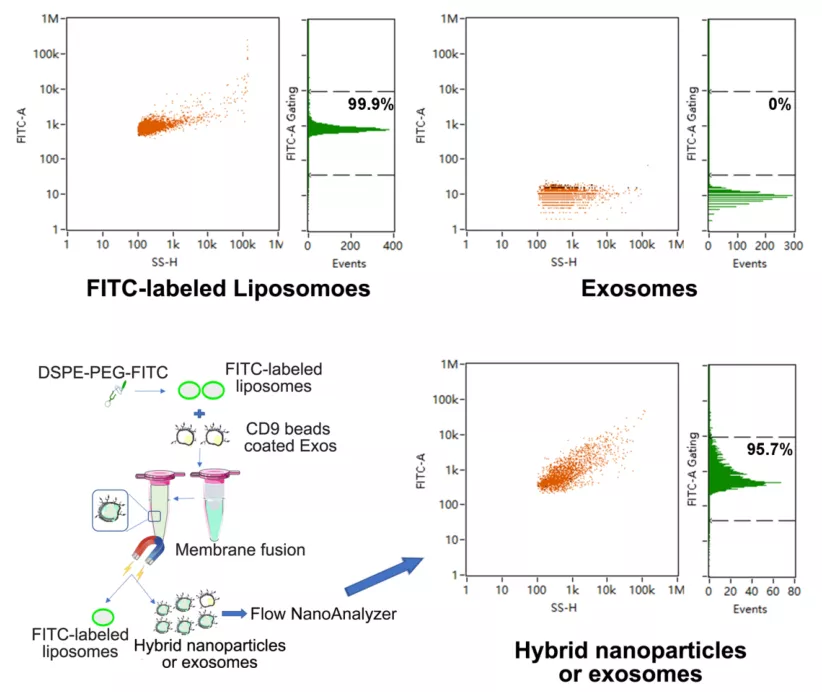
图2. 脂质体-外泌体融合流程和效率
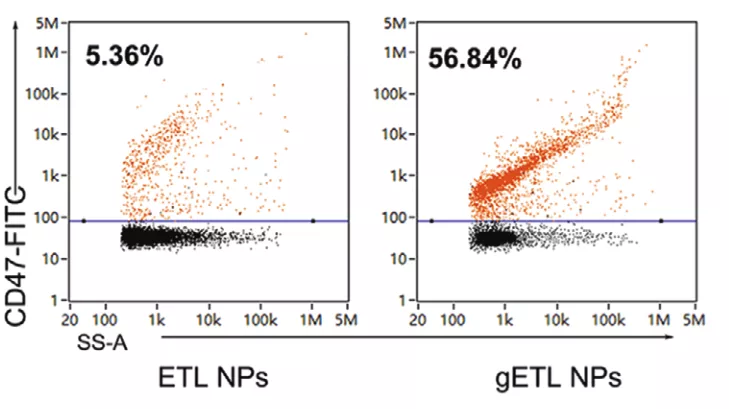
图3. 外泌体-脂质体纳米颗粒CD47表达比例检测
本文作者通过将热敏脂质体和外泌体融合,巧妙的将两者的功能相结合,既避免了药物被机体清除,又实现了靶向给药,显著提高转移性腹膜癌的治疗效果。在此过程中利用 NanoFCM的平台对脂质体和外泌体融合过程进行监测,进一步评估融合的效果,优化融合条件。
相较传统的 WB 或 ELISA 只能在整体水平对颗粒进行表征,纳米流式检测仪可在单个外泌体或脂质体水平对其表达的蛋白、药物包裹量、药物包裹效率等进行定性、定量分析,实时监测纳米药物合成过程,优化纳米药物生产条件,对纳米药物的生产工艺优化具有重要参考价值。
参考文献:
- Lv, Qijun, et al. “Thermosensitive Exosome–Liposome Hybrid Nanoparticle‐Mediated Chemoimmunotherapy for Improved Treatment of Metastatic Peritoneal Cancer.” Advanced Science 7.18 (2020): 2000515.



