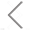商品化试剂盒对比
Author: Mika Huang Date: February 15, 2023
由于细胞外囊泡存在于细胞培养液以及血液、乳汁、尿液、腹水等多种复杂的生物环境中,且不同来源甚至同一来源的EVs在尺寸、形态和生化特性等方面存在着很大差异,因此,有效的分离纯化方法和检测手段是EVs走向临床的两大瓶颈。目前EVs的分离纯化方法主要有超速离心法、尺寸排阻法、聚合物沉淀法和免疫亲和法等。那么,这些EVs的分离纯化方法的纯化效果如何呢?在单颗粒水平对EVs进行表征对于EVs纯化方法的评估具有重要意义。EVs的单颗粒表征方法主要有冷冻透射电镜(cryo-TEM)、纳米颗粒追踪技术(NTA)和可调电阻脉冲传感技术(TRPS),虽然cryo-TEM可以对小粒径的EVs进行表征,但是其通量低、耗时长,获得的信息通常缺乏统计代表性,NTA和TRPS均难以实现粒径小于70 nm的EVs的表征。因此,cryo-TEM、NTA和TRPS均难以满足EVs的日常检测需求。
纳米流式检测仪为EVs检测开辟了蹊径,可以在无标记的情况下,对粒径低至40 nm的单个细胞外囊泡进行散射光的直接检测。该研究利用纳米流式检测仪,从EVs的颗粒浓度、粒径分布、纯度、表型和回收率等方面,综合比较了超速离心法以及五种商品化试剂盒(ExoQuick、Total Exosome Isolation、qEV Columns、Ultrafiltration和exoEasy)提取的EVs。该研究为EVs相关领域的研究者们提供了一套评估方法,研究者们可以根据结论选择适合自己的分离纯化方法。
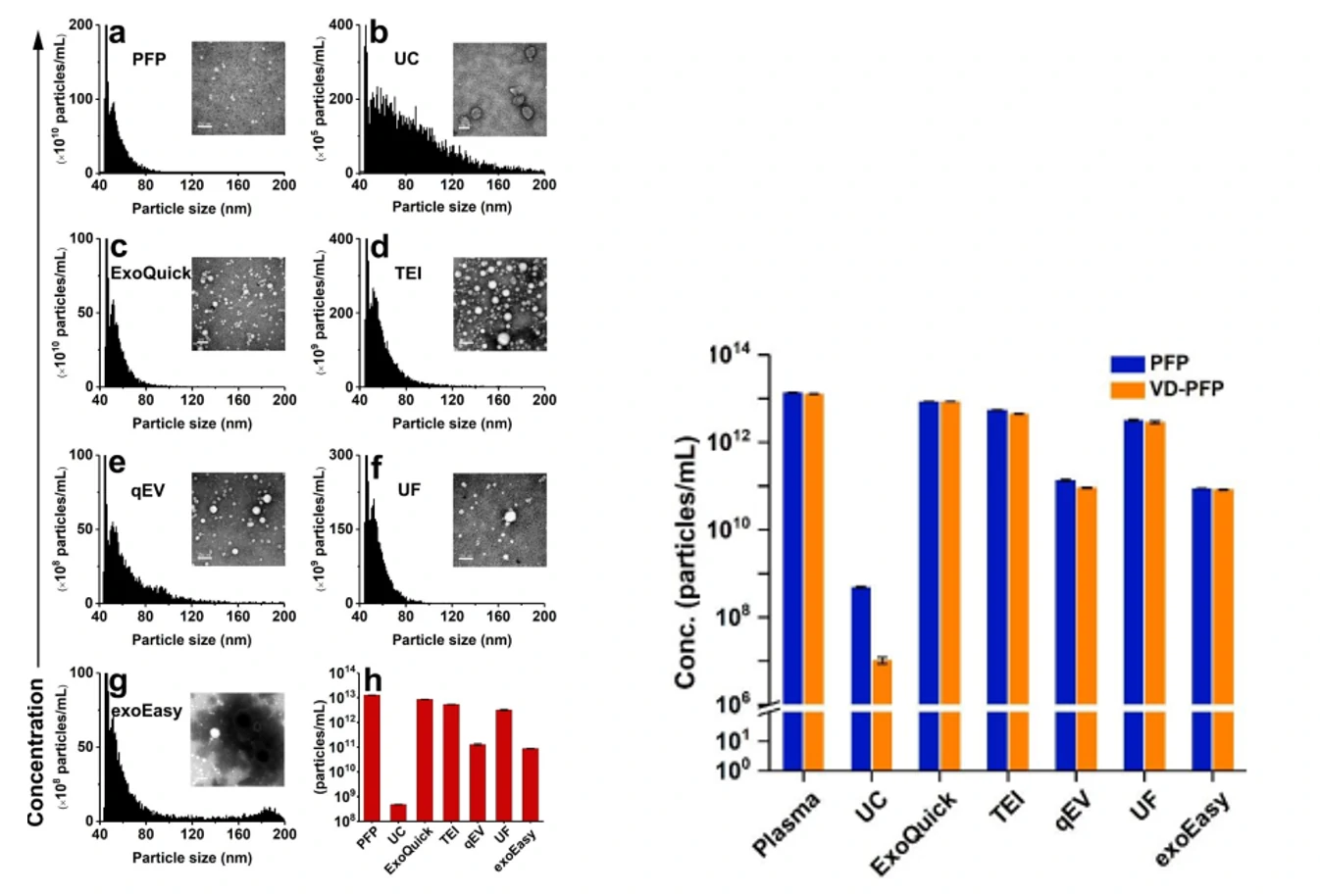
图1. 不同纯化方法得到的EVs的粒径分布和颗粒浓度 图2. 不同纯化方法提取PFP和VD-PFP得到的EVs的颗粒浓度

图3. 不同纯化方法得到的EVs的纯度表征 图4. 不同纯化方法得到的EVs的回收率表征
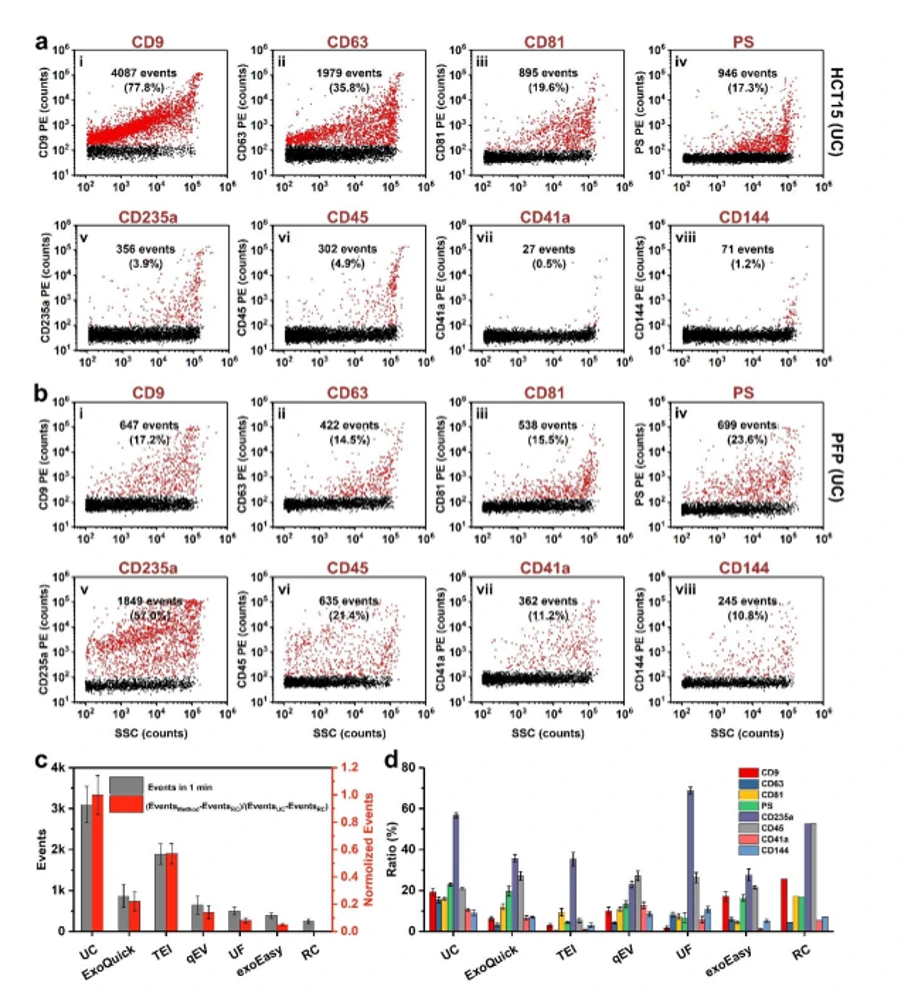
图5. 不同分离纯化方法得到的EVs的表型分析
NanoFCM的分析结果表明,UC分离方法得到的EVs的纯度达78%,而ExoQuick、Total Exosome Isolation、qEV Columns、Ultrafiltration和exoEasy五种快速分离纯化试剂盒提取的EVs纯度都较低;对于EVs的表面蛋白的鉴定,试剂盒提取的EVs也需用超离的方法进一步去除杂质颗粒,才能得出与UC相一致的结果;总的来说,常用的试剂盒提取方法与传统的超速离心方法比较还存在较大差距。
J Extracell Vesicles, 2019, 9(1), 1697028.