纳米药物应用方向
Author: Mika Huang Date: July 5, 2022
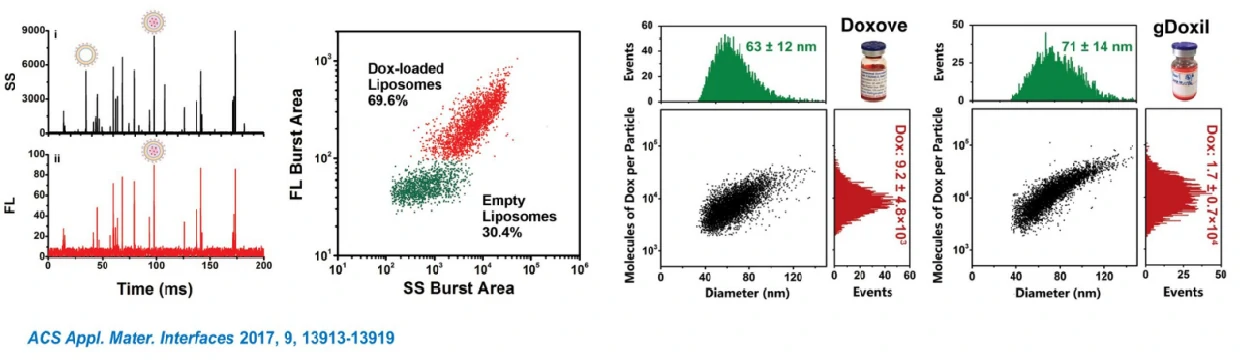
阿霉素脂质体
阿霉素脂质体的粒径分布表征通常需要使用冷冻透射电镜和复杂的三维重构技术,需耗时2-3天且获取的粒径分布结果统计代表性不高。另一方面,单个颗粒包裹阿霉素的效率则无法评估。这里,纳米流式检测仪用于单个脂质体颗粒的散射光和荧光信号的快速、同时测定,借助粒径标准品,仅需2-3分钟的时间即实现了阿霉素脂质体粒径分布、颗粒浓度和阿霉素包裹效率的定量表征。另外,纳米流式检测仪的荧光强度可以用于定量,通过荧光强度可在单颗粒水平进一步对粒径和包裹阿霉素的含量进行相关分析,得到单个阿霉素脂质体内阿霉素的拷贝数信息。这个方法为脂质体囊泡的多参数表征提供了一个高度实用的平台。
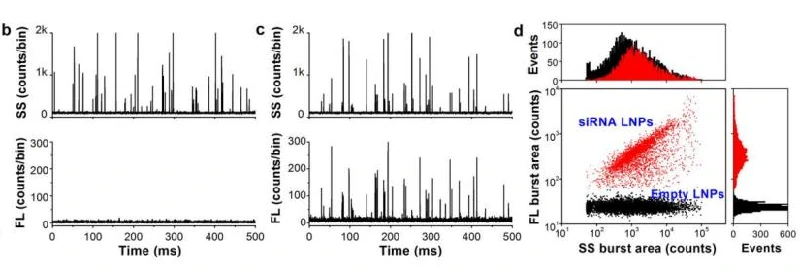
核酸纳米药物
因为核酸分子的负电特性,使其难以跨越细胞膜,进入胞内。研究人员开发了基于正电荷脂质分子合成的新型阳离子脂质(cationic lipids),形成阳离子脂质-核酸复合物,以提高细胞的摄取效率。然而,阳离子脂质体具有一定的细胞毒性,会导致细胞膜损伤,在治疗过程中可能引发不必要的毒副作用。为了降低纳米药物的毒副作用,需要尽可能地让每个颗粒都实现药物有效装载于颗粒内部而非吸附于表面。NanoFCM具有卓越的散射光和荧光检测灵敏度,散射光信号触发可实现鉴定和指认所有的脂质纳米颗粒,进一步通过核酸染色实现空壳率和装载效率的的评估。 目前临床证实携载siRNA的脂质纳米粒是最具潜力的RNA干扰药物之一,但是尚缺乏有效的表征手段来评价纳米药物的颗粒浓度和有效装载siRNA脂质纳米粒(LNPs)的比率这两项指标。在此,纳米流式检测仪对Alnylam公司II期临床试验(2014年数据,该药物已于2018年被FDA批准,名称为patisiran)中用于靶向肝脏的小核酸药物进行检测,利用跨膜核酸染料标记内部包裹的siRNA,即可快速判定纳米药物中siRNA的包裹效率。
ACS Nano, 2014, 8,10998.
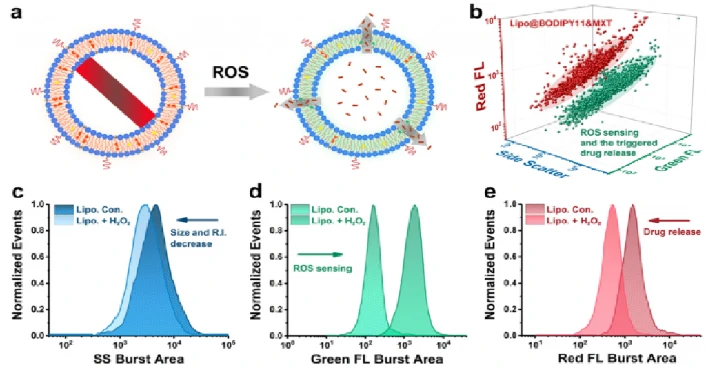
诊断治疗型脂质体
该研究制备了一种活性氧(ROS)响应性的脂质体(Lipo@BODIPY11),并以其为例,报道了一种利用纳米流式检测仪表征纳米药物的方法。光散射和荧光强度的同时检测为脂质体的质量评价提供了一种手段。可以在几分钟内快速获得以刺激反应能力和ROS治疗后的药物释放行为为指标的临床表现。此外,本方法还揭示了脂质体与功能模块的解离和高度修饰程度下形成聚集体,而这些过程在系综平均法下会被掩盖。该方法为生物化学纳米传感器和诊断纳米材料的原理验证研究、异质性评价和质量控制提供了一种综合的表征手段。
复合纳米药物
将包裹了抗肿瘤药物阿霉素的脂质体与定向改造后过表达CD47的外泌体混合,诱导其发生融合,融合后的颗粒既有包裹阿霉素,同时表面也有CD47。NanoFCM不仅可以测定融合的效率,同时也可以提供融合颗粒表面CD47的表达情况。NanoFCM为复合纳米药物提供全流程解决方案,评估初始原料的纯度和工程化修饰效果,优化融合条件,为融合效率的计算提供检测手段和数据支撑。




