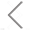细菌双杂交系统蛋白相互作用检测
Author: Mika Huang Date: February 21, 2023
蛋白-蛋白相互作用(protein-protein interactions, PPIs)的表征对于理解细胞信号转导通路至关重要。然而,结合强度的定量测量仍然具有挑战性。基于经典的细菌腺苷酸环化酶双杂交(bacterial adenylate cyclase two-hybrid, BACTH)系统,前期研究证实了相对报告蛋白表达(relative reporter protein expression, RRPE)是与两种蛋白之间相互作用结合强度相关的内在特征。
本研究通过CRISPR/Cas9技术将荧光蛋白tdTomato的基因插入染色体中,并使用12个氨基酸的四半胱氨酸(tetracysteine, TC)标记其中一个相互作用的蛋白质,可通过跨膜双砷染料进一步标记。TdTomato和TC-tag的联合使用可以通过纳米流式检测技术在单颗粒水平上对报告蛋白和蛋白相互作用的表达水平进行快速和高通量分析,从而简化了PPI的定量测量。此外,该研究还使用开发的RRPE-tdTomato-TC-BACTH方法,证明了该方法的灵敏度足以区分亲和力为1.4倍的微小差异,并且可以快速筛选出蛋白质相互作用抑制剂。
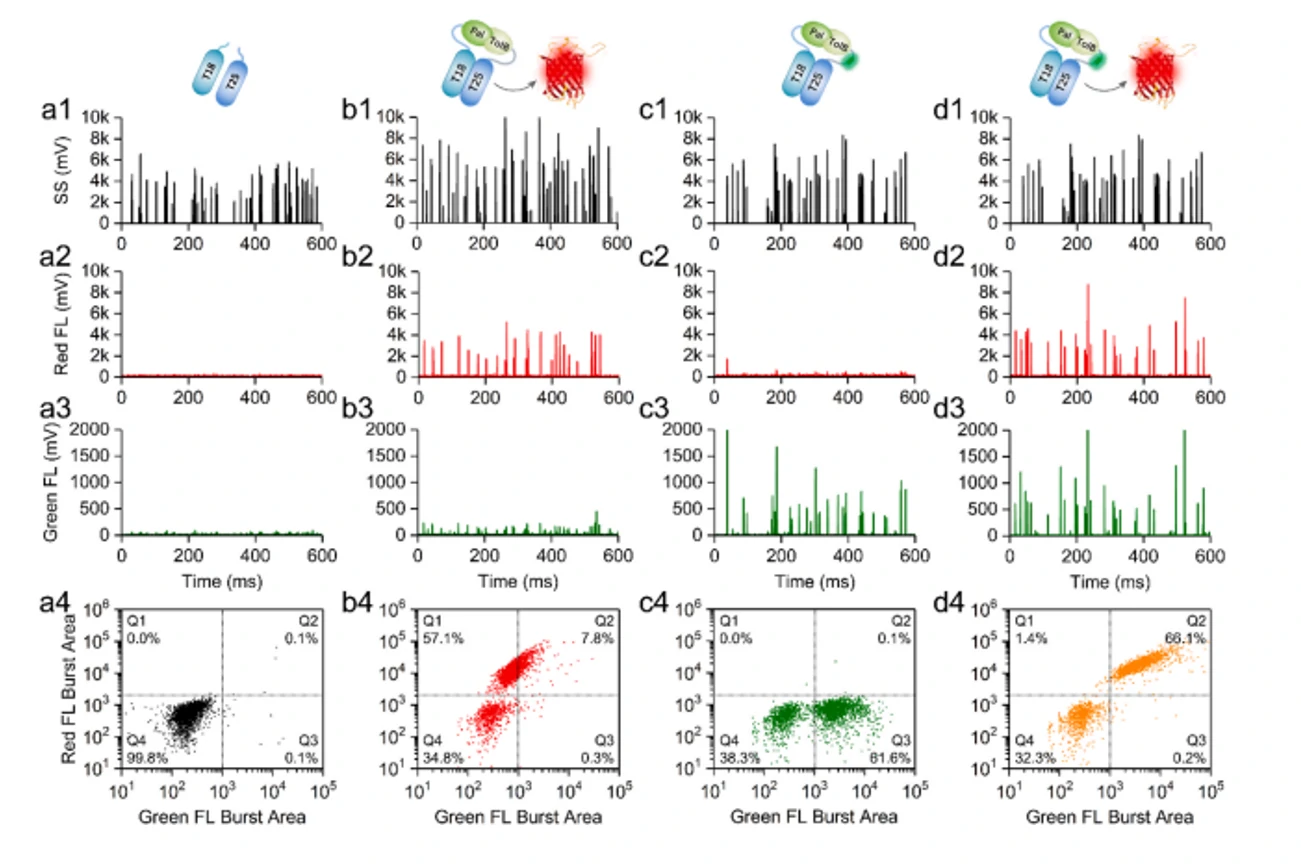
图1. 同时检测tdTomato–TC-BACTH蛋白的表达
图2. tdTomato-BACTH方法用于靶细胞的快速鉴定
结合双荧光标记分析法,纳米流式检测仪可以消除固定和渗透处理,大大加快样品分析速度。同时进行了定量分析蛋白相互作用和报告蛋白的表达。基于nFCM的tdTomato-BACTH方法,消除传统的琼脂电镀步骤,从而提供靶细胞的高通量鉴定,从而验证nFCM的tdTomato-BACTH方法具有高通量PPI研究的潜力。
Talanta, 2021, 233, 122549.