谁才是膜染料中的王者?
Author: Mika Huang Date: August 31, 2023
细胞外囊泡(EVs)作为疾病生物标志物和药物递送载体,具备巨大的临床潜力,已然成为当今生命科学和医学研究领域的“当红辣子鸡”。细胞种类、细胞状态以及分泌途径的多样性,从细胞上清或体液中分离得到的EVs在物理性质和分子组成上具有高度的个体差异性和多样性,此外,由于绝大多数EVs粒径小于200 nm且缺乏通用的标志蛋白,因此如何在单颗粒水平对其进行分析而揭示其异质性一直是亟待突破的瓶颈问题。磷脂双层膜结构作为EVs的固有特性,基于亲脂性膜染料(lipophilic membrane dyes, LMDs)的EVs荧光标记已成为一种普适性策略,广泛应用于荧光显微镜和流式细胞术等单颗粒EVs分析表征中。此外,亲脂性膜探针(lipophilic membrane probes, LMPs)因其对EVs脂膜的嵌入也被广泛用于EVs的捕获和富集。然而,不管是基于染料还是探针对于EVs脂膜的标记性能均尚未有系统的考察报道,譬如:
01 LMDs是否能够标记上所有的EVs?
02 LMDs在缓冲液中自团聚形成的荧光胶束颗粒对EVs准确检测的干扰情况?
03 LMDs是否也同样会标记EV样本中的常见污染物——脂蛋白,以及该标记对EV样本分析的影响?
2023年7月31日,厦门大学颜晓梅教授课题组在Journal of Extracellular Vesicles在线发表题为"Quantitative assessment of lipophilic membrane dye-based labelling of extracellular vesicles by nano-flow cytometry"的研究论文(JEV, 2023, e12351), 报道了该团队利用纳米流式检测装置(nano-flow cytometer, nFCM)对多种LMDs和LMPs标记EVs的效果进行定量评估,对EVs膜染料标记中常见的问题给出了答案。
如图1所示,EV样品与LMD稀释液进行共孵育,标记完成后超离去除游离的LMDs,随后在纳米流式上进行分析。如果一个颗粒只有散射光信号没有荧光信号,它就被认为是未标记的EV (Unlabeled EV)。再结合EV样本的纯度信息,即可通过荧光颗粒占总颗粒的比例,反映出LMD对EVs的标记效率。
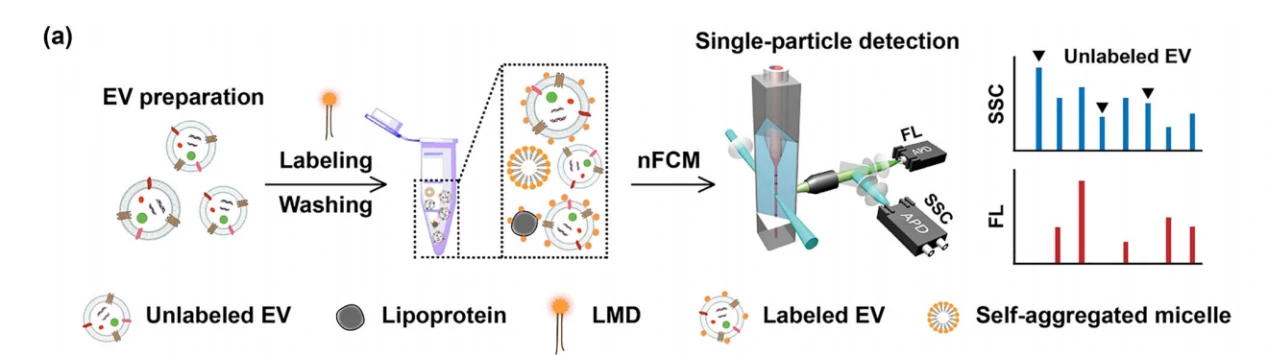
图1. 脂膜染料标记EVs及检测流程示意图
该研究选取了PKH67、PKH26、Di-8-ANEPPSF和Dil四种最常见的膜染料,分别对人工合成的脂质体、细胞上清和血浆等不同来源的EVs进行标记。首先验证了四种膜染料对脂质体的标记效率均接近90%,这与表面活性剂Triton X-100处理分析纯度(处理方法参见往期文章:外泌体纯不纯,一闻就知)的结果(93.2%)高度吻合,这也就说明四种LMDs对脂质体的标记不具有选择性。
细胞上清来源EVs的LMD标记
首先采用表面活性剂处理的方法对超速离心所得HCT-15细胞来源的EV样本纯度标定为88.3%,之后经不同浓度的LMDs(1、2、4和8 mM)的染色标记。结果表明PKH67和PKH26染料仅能标记约60%-80%的细胞培养上清来源EVs,而di-8-ANEPPS和高浓度的DiI可以实现样本中EVs的高效且均匀的荧光标记,其中di-8-ANEPPS的标记效率接近100%,而DiI的标记效率为70%-100% (图2)。

图2. HCT-15细胞来源EVs的LMDs膜标记效率分析
膜染料自身团聚
由于LMDs自身化学结构的特性,易发生自团聚而形成胶束颗粒。在此对所选择的四种LMDs(PKH67、PKH26、Di-8-ANEPPSF、Dil)的自团聚情况进行了考察,以探索形成胶束对于EVs分析的影响。结果发现,随着LMDs浓度从 1 mM升高至8 mM的过程中,自团聚颗粒数增加但其颗粒粒径和荧光强度基本不变;且PKH67和PKH26相较于di-8-ANEPPS和DiI更容易形成自团聚胶束,但是各自染料的最佳染色浓度下,自团聚产生的胶束颗粒数量较低,对整体结果影响较低。
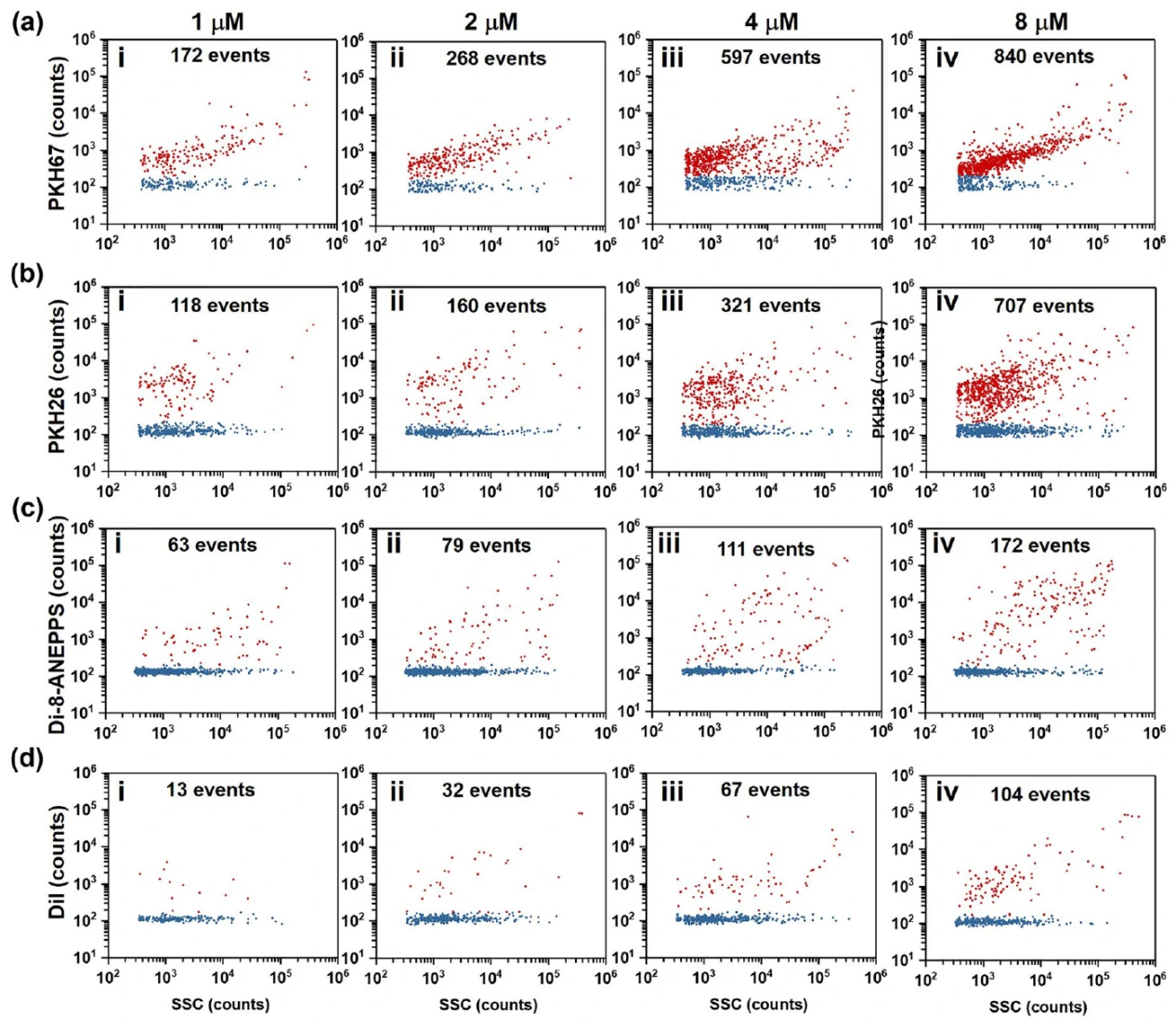
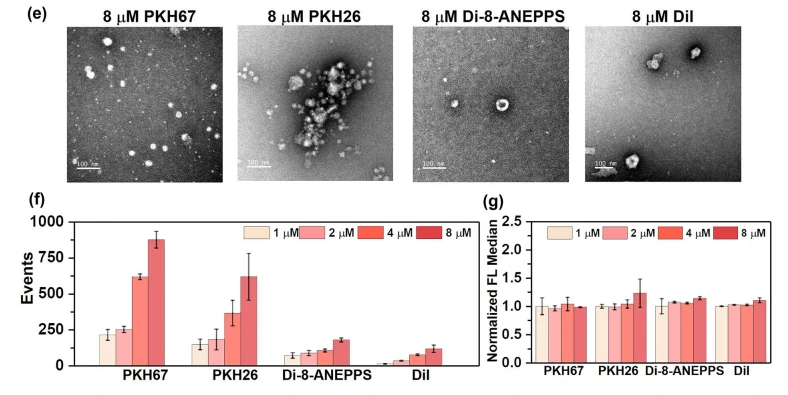
图3. PKH67、PKH26、di-8-ANEPPS和DiI的自团聚情况评估
LMDs对血浆来源EVs的标记
血浆中大量脂蛋白和乳糜颗粒的存在,易导致来源于血浆的EV(PFP-EVs)样本中通常会存在脂蛋白和其他蛋白团聚体的污染。作者在此选择与EVs粒径和密度均高度重叠的极低密度脂蛋白(very-low-density lipoprotein, VLDL)作为研究模型来评估LMD对常见污染物的标记(图4)。四种LMDs对几乎所有的VLDL颗粒均可进行标记,这也说明了脂蛋白等杂质的存在会对依赖LMD标记的EV分析产生干扰。不同健康志愿者PFP-EV样本的纯度存在一定差异,平均为73%。结果显示PKH67和PKH26染料仅能够标记约40-70%的PFP-EVs,且过量的PKH26会对EVs的结构造成损害。Di-8-ANEPPS的标记比例为80%,高于EV样本的纯度,推测是EV样本中的其它类型脂蛋白也可能被该染料所标记。

图4. LMDs对VLDL和血浆来源EVs的标记
脂膜探针标记和拷贝数分析
除了用于EVs的标记之外,LMPs也常被用于EVs的捕获和富集。在此以DSPE-PEG2000-biotin为研究模型,其中DSPE采用长疏水的碳链结构嵌入到EVs的磷脂双层膜中,PEG则可以提高试剂的水溶性,而biotin标签则可以用于后续的亲和素的捕获或者标记。如图5所示,对于DSPE-PEG2000-biotin孵育后的EVs采用streptavidin-Alexa Fluor 532(AF532)进行标记。1~8 mM浓度的DSPE-PEG2000-biotin对于HCT-15和CCD-18Co两种细胞来源的EVs的标记效率是稳定的且与EVs的纯度相当。此外,基于nFCM高灵敏的荧光检测能力,研究人员首次实现了单个EVs膜表面LMPs嵌入个数的绝对定量。单个EVs上LMPs的拷贝数分布从单拷贝到3107不等,中位值为37;同时发现证实LMPs对EVs的脂膜标记不会干扰抗体对于免疫表型的分析。
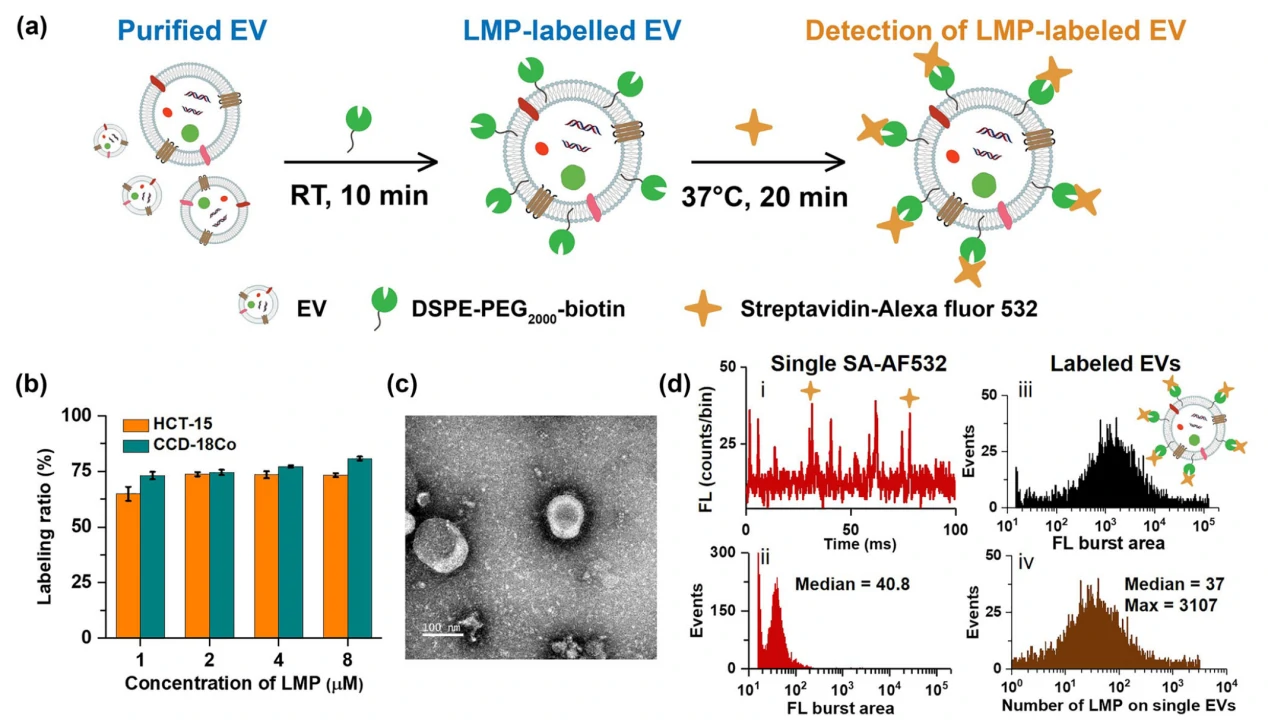
图5. 不同来源EVs的LMP标记特性
综上,作者在该论文中通过nFCM在单颗粒水平对纳米生物颗粒进行高通量、多参数定量分析的性能系统地评估了LMDs/LMPs对于不同来源EVs以及脂蛋白的标记性能,让研究者们再次以独道的视角重新审视LMDs/LMPs在EV研究中的应用和限制。
Note:
这个文章的价值其实是建立了膜染料的评价方法。该文章选取的样品类型是哺乳动物(人)细胞产生的EVs,选取的染料数量还比较少,市面上有更多类型的商品化膜染料值得探索。由于膜结构的差异,对于植物来源、微生物来源的EVs,膜染料的适用性需要另行评估。



