腺相关病毒AAV空壳率测定
Author: Mika Huang Date: March 2, 2023
腺相关病毒(adeno-associated virus, AAV)是目前发现的一类结构最简单、无包膜的单链DNA缺陷型病毒,属于微小病毒科(Parvoviridae)家族,粒径仅22-26 nm。由于其安全性好、宿主细胞范围广(分裂和非分裂细胞)、免疫源性低、在体内表达外源基因时间长等特点,已成为细胞与基因治疗最常用的载体。AAV载体在生产过程中需要严格地监控把关,以保证临床的安全性和有效性。在AAV生产过程中除了需要对载体滴度、产量、生产活性进行严格监控外,最具挑战的是去除空的病毒颗粒或者含有全长基因以外DNA的病毒载体颗粒。目前常用的分析AAV载体空壳率的方法包括qPCR/ELISA、透射电子显微镜法、分析型离子交换层析法和分析型超速离心技术等,每种分析方法有一定的适用范围也存在一定的局限性。
本研究基于纳米流式检测仪结合AAV空壳率检测试剂盒开发了一种对AAV病毒空壳率的定量分析方法,操作简单、检测速度快、准确性高、通用性广,能够实现对病毒产物特性的高分辨和定量分析,为AAV载体空壳检测提供新的有效、快速、简便的检测分析方法。
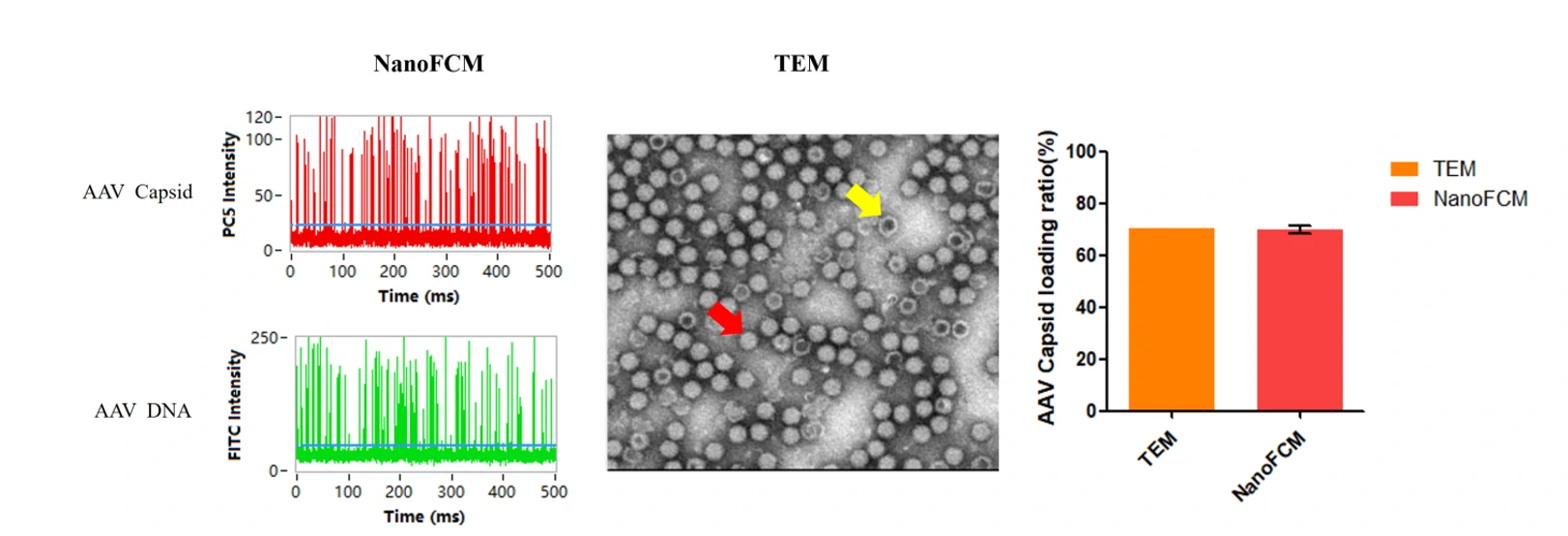
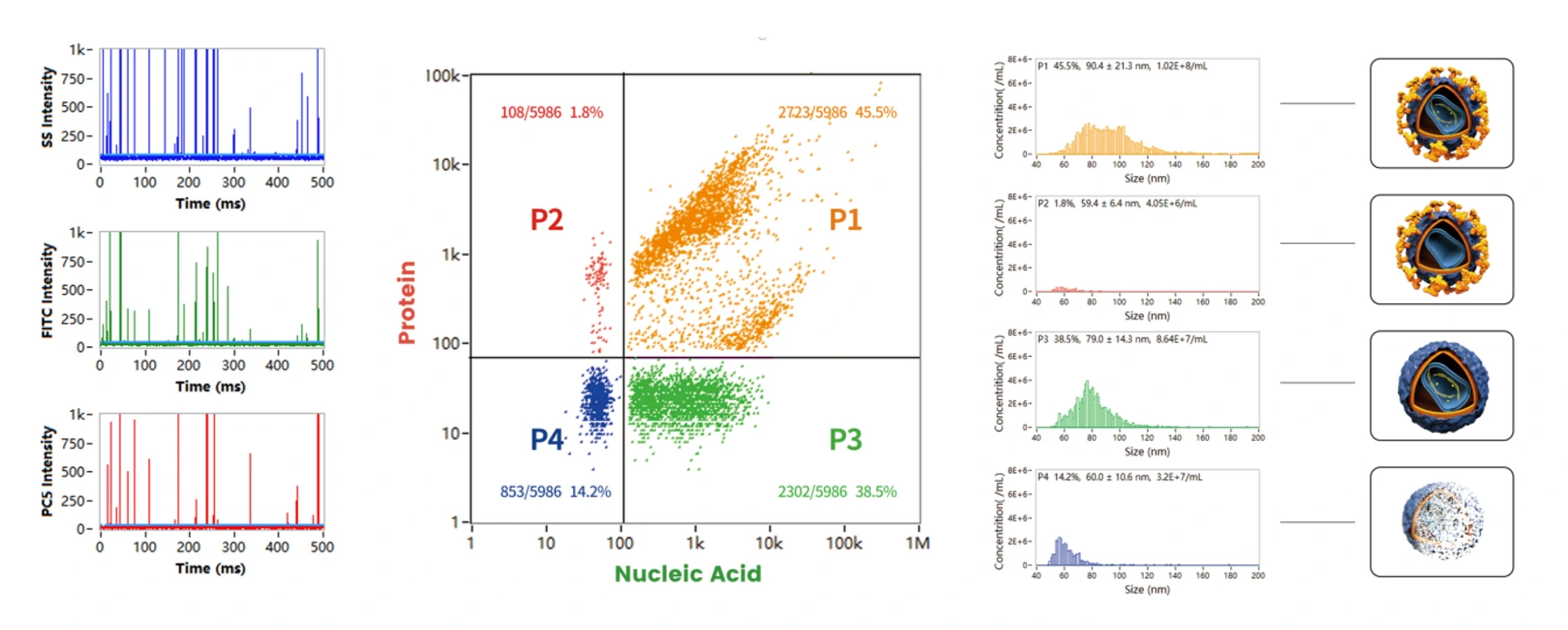
图1. AAV空壳率分析策略与不同方法的结果比较
基于AAV空壳率检测试剂盒,经纳米流式检测仪分析,得到完整的AAV8病毒的比例为70.9%,与通过透射电子显微镜统计获得的结果70.39%吻合,该方法仅需不到1 h,10 μL原液即可实现,大大节省了时间和样本用量。纳米流式检测仪为AAV载体空壳率检测提供创新的快速、简便且低成本的分析方法。
Copyright © 2022 NanoFCM Inc.