mRNA递送系统在疫苗研究中的应用网络研讨会
Author: Mika Huang Date: September 20, 2022
2020年初开始的新冠疫情全球大流行,其影响仍在持续。截止2022年9月15日,全球新冠肺炎确诊病例近6.06亿,累计死亡人数超过650万。毫无疑问,疫苗已成为全球范围内应对新冠疫情的重要利器。随着各国疫苗的获批和接种,新冠疫情快速蔓延的势头得到有效遏制。截至目前全球范围内已经累计接种126.5亿剂疫苗,仅国内的接种量就高达34.3亿剂,庞大的接种人数也催生了巨额的新冠疫苗市场。
据不完全统计,在过去的2021年,全球排名前十的疫苗企业总营收达到1359.2亿美元,其中单新冠疫苗的贡献就超过1000亿美元。值得注意的是,2021年mRNA疫苗的市场规模达到580亿美金,目前被辉瑞/BioNTech(403亿美元)和Moderna(176亿美元)牢牢占据。得益于在新冠疫情应对中取得的成功,mRNA疫苗也从籍籍无名到人尽皆知。
mRNA疫苗简介
根据不同的技术路线,目前已获批上市或在研的新冠疫苗包括灭活疫苗、重组亚单位疫苗、病毒载体疫苗、减毒活疫苗和核酸疫苗等几类。以mRNA为代表的核酸疫苗是通过递送载体将编码关键蛋白的核酸直接递送到胞内,翻译产生抗原,诱导机体产生免疫应答(图1)。相比于其他类型的疫苗,mRNA疫苗具有明显的优势,如:研发周期短;安全性高,不存在感染或插入突变的风险;有效性高且稳定,在细胞质中被高效摄取和表达;生产难度低、速度快且安全。另外,mRNA疫苗能够同时激发强烈的体液免疫和细胞免疫,因而被视为最有潜力的疫苗。
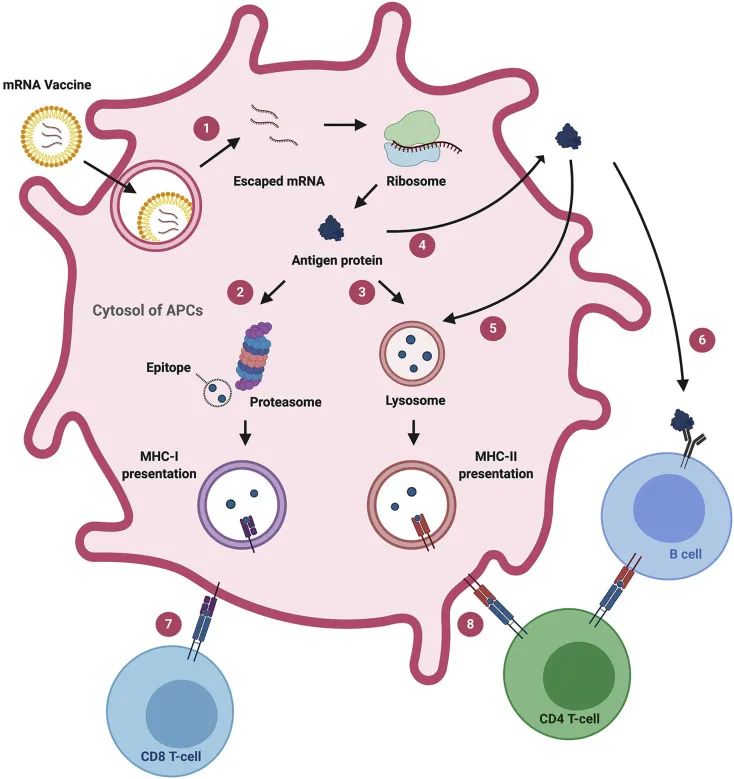
图1. mRNA疫苗作用机制
mRNA技术难点
在mRNA疫苗实际生产路径中(图2),初期通过设计与构建表达载体,历经大肠杆菌扩大培养、质粒线性化、体外转录、加帽、加尾以及一系列的纯化、除菌等过程即可获得大量的mRNA,随后,利用递送系统将纯化的mRNA封装在其中,由此产生的formulation经过浓缩、缓冲液交换和无菌过滤等,在评估合格后即可封装成药。mRNA疫苗面临的最大挑战是选择正确的抗原序列并优化和选择合适的递送系统,一个优质的递送系统需要具备解决细胞外屏障、内体逃逸和细胞内免疫等难点的能力,目前,学术界和工业界开发了多种用于mRNA递送的材料,如脂质纳米颗粒(LNPs)、脂质体、脂质复合物、外泌体、高分子聚合物、多肽等,其中,LNPs应用最为广泛,为核酸药物的快速发展奠定了坚实的基础,广泛应用于递送小分子、寡核苷酸、siRNA药物以及mRNA等。LNPs的使用上如何突破或绕开国外专利壁垒以及解决工艺参数的优化难题,仍是国内mRNA药物行业需要解决的问题。

图2. mRNA疫苗工艺路线及流程
一些从业者另辟蹊径,尝试利用天然的递送系统——外泌体替代脂质纳米颗粒行使递送的功能,因其免疫原性低、生物相容性好、靶向性强等优势,外泌体被mRNA领域寄予厚望。
疫苗质量控制需求
mRNA疫苗在体的行为由其理化性质所决定,需严格控制疫苗颗粒的大小、分散性、以及mRNA的包封率和拷贝数等参数。mRNA疫苗的颗粒大小影响其生物分布、免疫原性以及其被细胞摄取的效率,与疫苗的安全性息息相关;而mRNA包封率和拷贝数则直接影响疫苗的有效性和给药剂量。对mRNA疫苗进行严格的表征、质量控制以及稳定性跟踪是保证疫苗安全性和有效性的关键。
mRNA因其技术优势,理论上可以表达任何类型的蛋白质,除了疫苗之外,在基因替代疗法、肿瘤治疗、基因编辑等领域也有着极为广阔的应用前景。mRNA疫苗的商业成功也为RNA的其它应用指明了道路。
特邀嘉宾
本期我们邀请了国药集团中国生物研究院的安文林主任和福流生物的应用总监田野博士,两位嘉宾将着力探讨mRNA递送系统在疫苗研发中的前景、递送系统选择、质控要点及新兴技术的应用等,为新冠以及其他类型疾病mRNA药物的研发和生产质控梳理思路,添砖加瓦。


扫码进入直播间
参考文献
1.Jeonghwan Kim et al. Self-assembled mRNA vaccines. Advanced Drug Delivery Reviews.2021,170, 83–112.
2.Cameron Webb et al. Current Status and Future Perspectives on MRNA Drug Manufacturing. Molecular Pharmaceutics. 2022, 19, 1047-1058.



