mRNA递送系统 —— LNP or 外泌体?
Author: Mika Huang Date: April 19, 2022
在新冠疫情全球大流行的背景之下,mRNA疫苗一战成名。辉瑞和BioNTech合作开发的Comirnaty (BNT162b)在2021年销售收入403.4亿美元,Moderna的Spikevax (mRNA-1273)收入176.75亿美元。近日,政府层面多次提及mRNA疫苗,国内企业研发进度加速,康熙诺生物、石药集团、沃森生物/艾博生物、斯微生物、艾美疫苗等企业研发的新冠mRNA疫苗均已处于不同的临床阶段。未来的十年将是mRNA行业蓬勃发展的大时代。
mRNA疫苗是核酸药物的一种,核酸药物从基因水平对患者进行治疗,只需针对目的基因开发合适的序列,即可开发相应药物,避免了研发过程的盲目性。核酸分子在体液循环系统中易被降解,具有免疫原性,易被富集于肝脏等器官。目前核酸药物递送最常用的是脂质纳米颗粒(lipid nanoparticle, LNP)载体,但其存在潜在的细胞毒性、无法靶向特定组织、细胞摄取效率低等不足,因此如何在保证安全性的前提下将核酸分子成功、有效地递送到特定的组织器官仍然具有挑战性。
外泌体作为新型纳米药物递送系统,一经发现就备受学术界和工业界关注。外泌体作为递送载体具有诸多优势,如:
1.通过工程化修饰,可靶向到特定的组织和器官,解决传统递送系统无法解决的问题;
2.无免疫原性,包裹的核酸药物不易降解,降低药物全身暴露毒性;
3.可跨越血脑屏障,实现颅内药物递送。基于以上特点,外泌体结合核酸疗法已成为新的热点。
目前,美国Codiak Biosciences公司的exoASO-STAT6外泌体核酸药物已进入I期临床试验,通过在外泌体表面携带反义寡核苷酸(ASO),降低免疫抑制转录因子的表达,促进抗肿瘤免疫反应。英国EVOX Therapeutics通过其自主研发的DeliverEXTM平台开发装载mRNA和siRNA外泌体的产品,期待在罕见病和神经类疾病的治疗上有所突破。
外泌体向人们展示了其在核酸药物递送中无可比拟的优势。由于外泌体本身也含有核酸分子,影响着受体细胞的生理状态。因此在递送核酸药物之前,对外泌体自身运载核酸分子的解析显得尤为重要,这将为外泌体的核酸递送的发展提供切实可靠的指导意义。小编给大家分享一篇文章,大家可以思考一下对于当红的mRNA疫苗如果基于外泌体来递送是不是更具优势?
近日,厦门大学颜晓梅教授课题组在Journal of Extracellular Vesicles(IF = 26)在线发表题为“Analysis of extracellular vesicle DNA at the single-vesicle level by nano-flow cytometry”的研究论文,在单颗粒水平对EVs的DNA进行综合表征,分析了EVs携带的DNA种类、含量、分布等情况,有望为外泌体核酸载药奠定基础。该研究利用NanoFCM结合SYTO 16核酸染色和酶消化策略对EVs和DNA进行全方位表征,发现:
- 超离获取的EVs样本中含有大量游离的DNA,单个EVs中EV-DNA的含量表现出很大的异质性,根据细胞类型的不同,DNA阳性EVs(DNA+EVs)的比率占总EVs的30% – 80%;
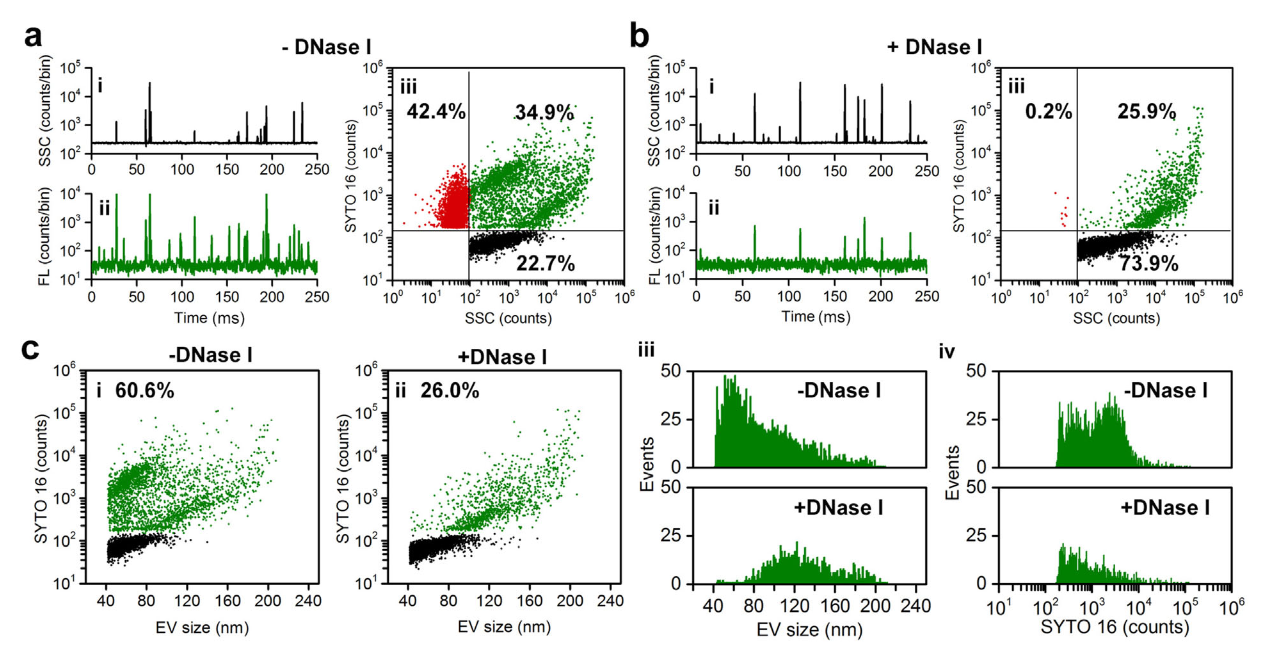
图1.EVs中DNA的分布情况
- EVs中的DNA主要是双链DNA(dsDNA),经过抗肿瘤药物诱导,DNA+EVs的分泌量和运载的DNA含量均明显增多;

图2.抗肿瘤药物促进EVs和DNA的分泌
-
首次发现尺寸排阻色谱(SEC)不能有效地将游离DNA从EVs中分离出来,而密度梯度离心可去除绝大部分游离DNA。该实验结果提醒科研人员在利用外泌体包载核酸时,需要特别注意真实核酸包裹量和游离核酸的监测,选取合适的游离核酸去除方法。
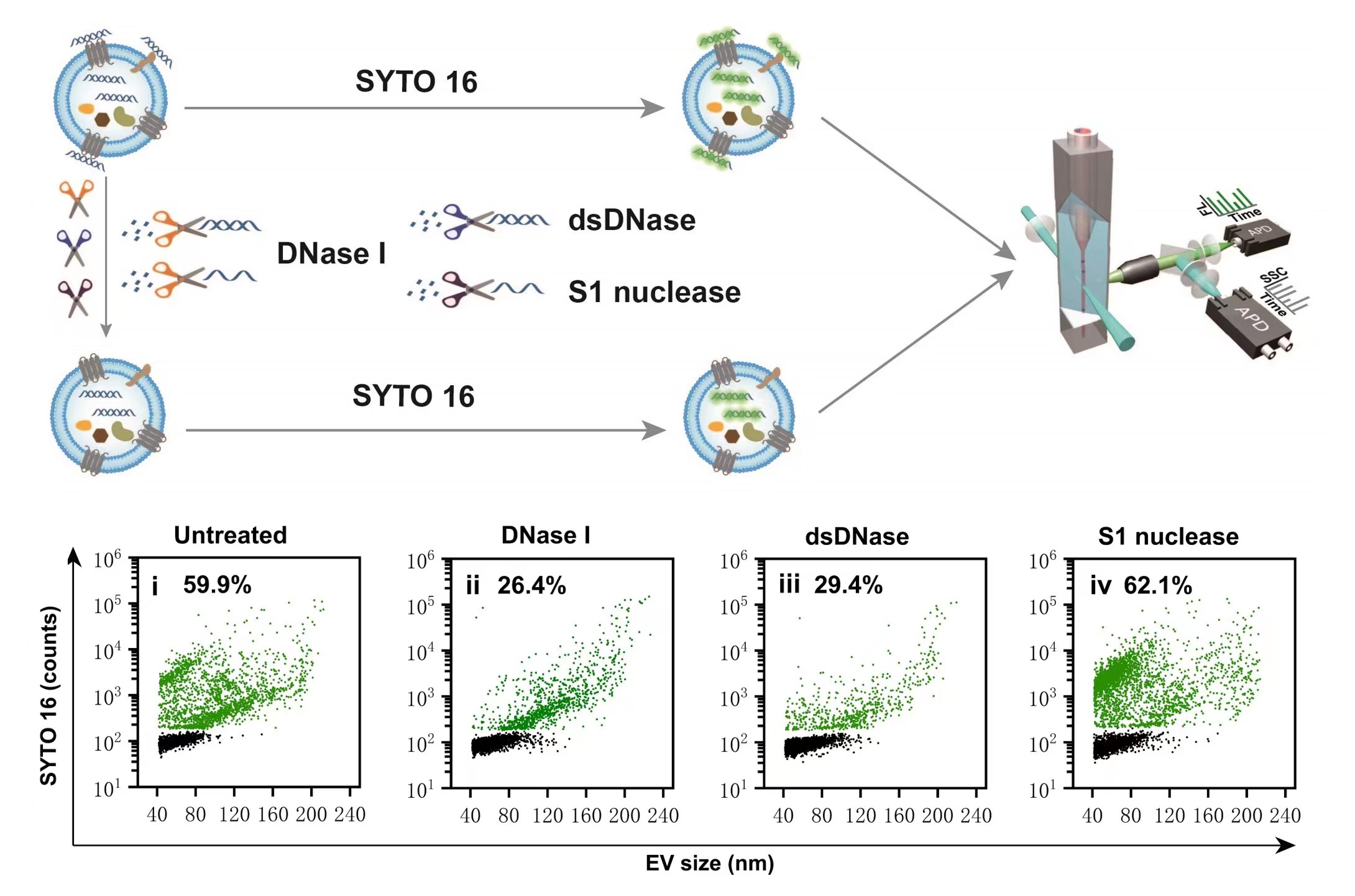 图3.EVs中核酸种类鉴定
图3.EVs中核酸种类鉴定
这项研究为深入了解DNA与EVs的关系提供了直接和确凿的实验证据,为后期外泌体装载核酸提供理论经验和基础,有望促进外泌体核酸药物的研发。NanoFCM可在单颗粒水平对EVs游离的核酸和内部核酸进行定量分析,确定DNA在EVs中分布情况,优化核酸投料量、缓冲液体系、孵育时间等核酸包裹条件,另外可评估不同纯化方法对EVs游离DNA的影响。NanoFCM对EVs核酸药物装载研究具有如下优势:
-
- 可检测到200 bp 单个游离的DNA超高灵敏度,实现EVs内部核酸、表面核酸、游离核酸的精确定量分析。
- 检测范围覆盖整个外泌体(40—200nm)粒径范围,对整体外泌体核酸装载分布进行分析。
- 在单颗粒水平测定EVs核酸的种类和含量 ,确定核酸包封率和含量
- 优化核酸装载条件、纯化方法等,获得高质量外泌体核酸药物。
参考文献:
- Haisheng Liu etal. Analysis of extracellular vesicle DNA at the single-vesicle level by nano-flow cytometry. Journal of Extracellular Vesicles, 2022, e12206.
- Thomas C. Roberts et al. Advances inoligonucleotide drug delivery. Nature reviews Drug Discovery (2020),19, pages 673–694
- Kulkarni, J.A. et al. “The Current Landscape of Nucleic Acid Therapeutics.” Nature Nanotechnology, 2021,16(841):630-643



