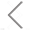核酸药物应用方向
Author: Mika Huang Date: July 1, 2022
纳米药物无标记分析
NanoFCM可在单颗粒水平实现纳米药物的粒径分布和颗粒浓度的无标记分析。如图所示,mRNA脂质纳米颗粒(lipid nanoparticles, LNPs)样本的粒径分布为40-200 nm,中位值为97 nm;通过单颗粒计数方法标定该样本中颗粒浓度为3.11E11 particles/mL。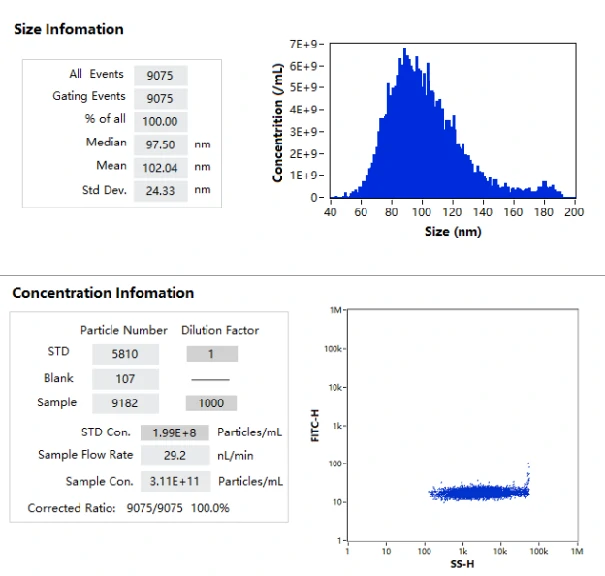
图1. mRNA LNPs的粒径和浓度分析
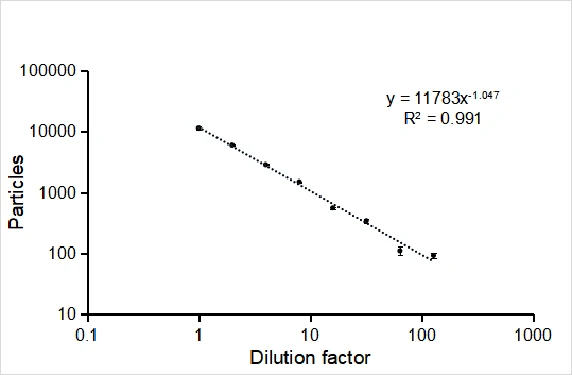
图2. mRNA LNPs的浓度梯度稀释曲线
空壳率分析
携载siRNA的脂质纳米粒是目前临床证实最具潜力的RNA干扰药物,但是纳米药物的颗粒浓度和装载siRNA脂质纳米粒(LNPs)的比率这两项指标目前尚缺乏有效的表征手段,由于空白的与装载了siRNA的脂质纳米颗粒粒径、形状和密度均非常类似,即便采用价格极其昂贵的冷冻透射电镜仍然无法确认纳米颗粒是否装载了siRNA。 在此对Alnylam公司II期临床试验中用于治疗肝病的纳米药物进行多参数定量表征,利用跨膜核酸染料SYTO 82标记内部包裹的siRNA,即可快速判定纳米药物中siRNA的包裹效率。通过单颗粒计数可以快速获得脂质纳米颗粒的浓度信息,从而对siRNA进行浓度定量和拷贝数分析。
图3. NanoFCM对siRNA LNPs包裹效率评估
经跨膜核酸染料标记后,对于未装载siRNA的LNPs,其荧光通道无信号;在装载siRNA后,荧光通道有信号且与散射通道信号一一对应,结果显示99%以上的LNPs颗粒均实现了siRNA的成功装载,且siRNA的装载含量与LNPs的大小呈正相关。此外,我们对两款mRNA纳米药物的装载效率进行了表征,结果表明分别有97.7%和90.3%的LNPs成功装载了mRNA分子,空壳率分别为2.3%和9.7%。
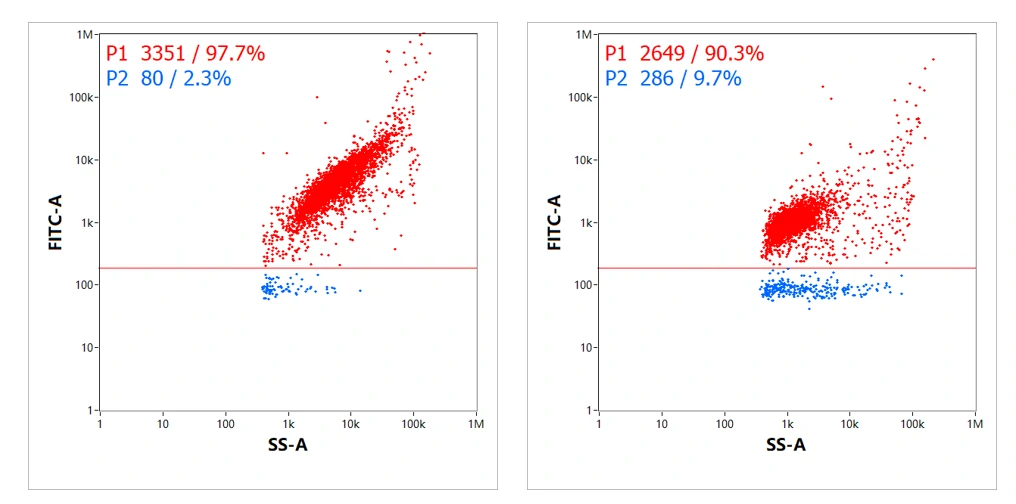
图4. mRNA LNPs的装载效率
核酸拷贝数
mRNA脂质纳米颗粒经跨膜的核酸染料标记后,在荧光通道观察到部分游离的RNA分子产生的信号(没有相应的散射光信号),且信号强度(FL Intensity)普遍低于与散射光信号相关的荧光信号(如下图箭头所示)。通过对RNA核酸分子的染色标记进一步确认了这部分荧光信号来源于单个游离的RNA。因为荧光强度与核酸分子长度成线性正相关关系,将每个包裹了RNA的纳米颗粒的荧光强度除以单个游离的RNA分子的荧光强度,即可实现每个RNA纳米药物内包裹RNA拷贝数的定量。 经上述方案统计了每个纳米药物内RNA拷贝数,其分布广泛,从一个到几十个不等,中位值为12个。
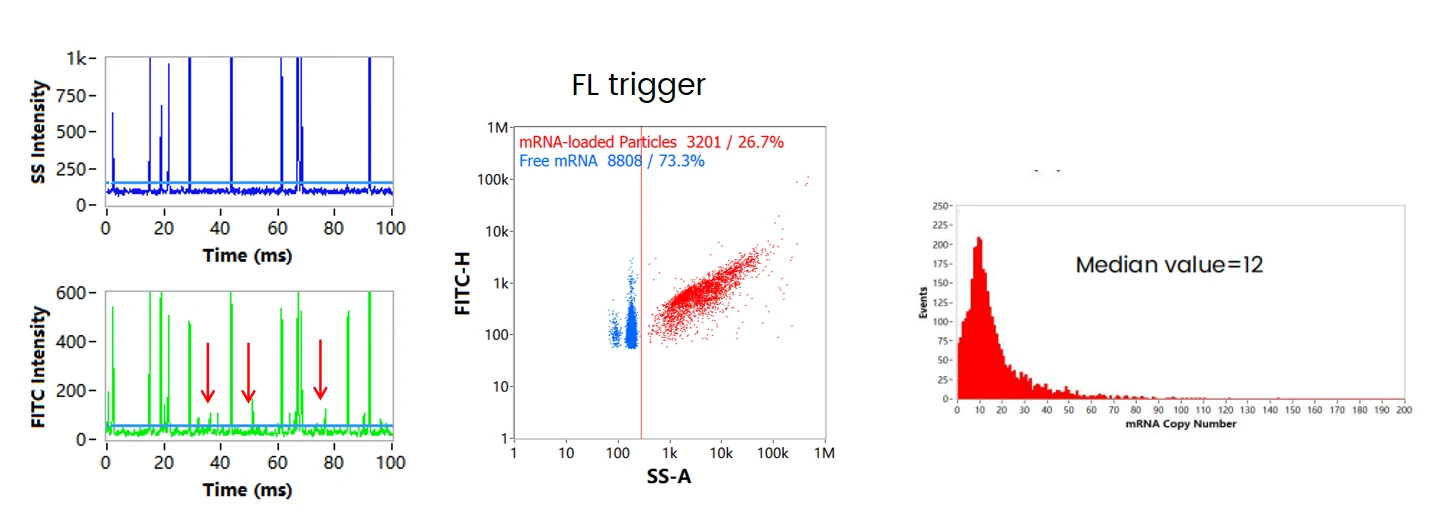
图5. 核酸纳米药物分析
核酸定位分析
表2详细概括了通过不同的标记策略来进行核酸定位分析的情况,相关人员可以采用同样的标记策略对mRNA LNPs进行核酸定位分析,进而优化合成方法和下游工艺流程,尽可能地将mRNA的有效装载最大化,获得高纯度、高装载效率的mRNA LNPs产品。

功能化修饰
以阿霉素脂质体为研究对象,通过表面偶联叶酸建立靶向修饰的方法,结合免疫荧光染色以及单颗粒分析等策略,NanoFCM检测技术分析发现对于粒径中位值为87 nm的脂质体,表面叶酸的密度为0.5~2.0个/nm2时,该纳米药物在靶向侵染细胞时具有最优效果(如下图)。进一步将该方法推广到转铁蛋白和人类表皮生长因子受体抗体的修饰及细胞侵染能力评估。NanoFCM为纳米药物功能化修饰的定量表征提供一种可行的解决方案。
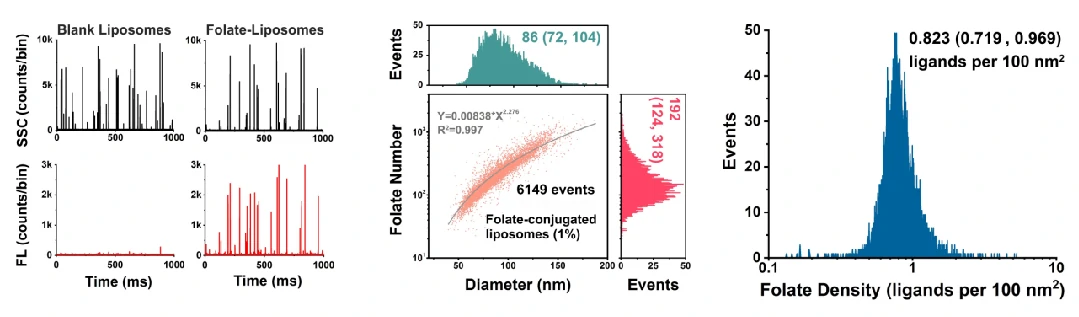
图6. 利用NanoFCM对LPs表面修饰的叶酸进行定量分析