mRNA LNP疗法:这才哪跟哪儿?
Author: Mika Huang Date: December 7, 2022
近十年来,基于脂质纳米颗粒(lipid nanoparticles,LNPs)载体开发的信使核糖核酸(mRNA)疗法已经进入临床试验招募阶段。新冠疫情爆发后,Pfizer/BioNTech和Moderna公司开发的mRNA疫苗在全球范围内广泛使用,更是将mRNA疗法推向了全新的高度。虽然这些mRNA疫苗针对COVID-19表现出了高的保护率,其中Pfizer/BioNTech的BNT162b2保护率可高达94%,但是免疫反应失控和药物干预不当代来的安全性和副作用仍然不容忽视。
本文将对mRNA药物的主要组成——LNP(递送系统)和mRNA分子分别与免疫系统之间的相互作用展开讨论,并探讨靶向修饰策略和新一代递送系统的开发,为在临床中通过调节药物的免疫反应来改善mRNA疗法的治疗效果提供新的思路。
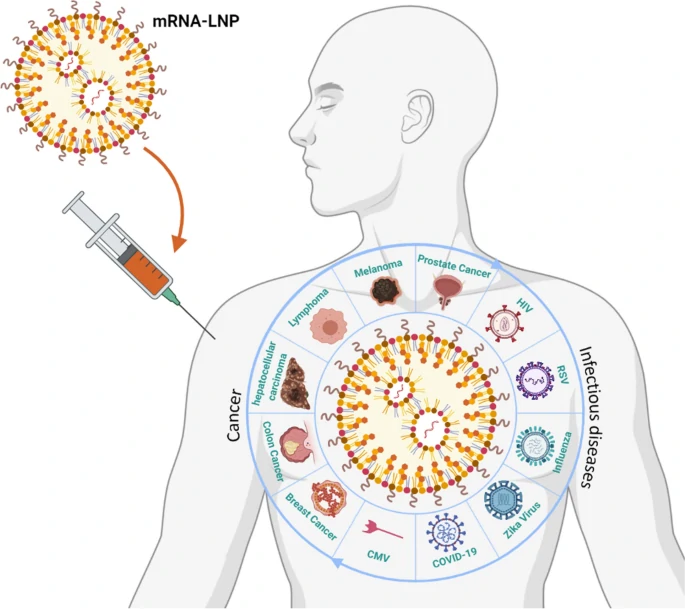
图1. mRNA LNP对抗癌症和传染性疾病
一、mRNA递送系统
mRNA的应用主要包括蛋白质替代疗法、癌症免疫治疗、疫苗、细胞重编程和基因编辑等。然而,mRNA的应用主要受限于体内递送的挑战,如核酸酶的降解,缺乏稳定性,内体捕获等。此外,mRNA的免疫毒性也是其成药能力的另一大挑战。因此,通过核酸修饰以提高mRNA的稳定性和开发高效的mRNA递送平台成为mRNA疗法的重中之重。
其中,递送平台主要分为病毒载体(天然)和非病毒载体(人工合成)两大类(图2)。病毒载体具有高效的宿主细胞转染能力以及低脱靶效率,然而所引发的免疫原性和细胞毒性问题、反向基因组插入风险、瞬时基因表达控制和载体大小限制也成为其主要限制因素。相比于病毒载体,非病毒载体则普遍表现出更低的先天免疫刺激和细胞毒性,且可通过靶向递送实现多个组织的有效转运,并避免与非靶细胞的非特异性相互作用。
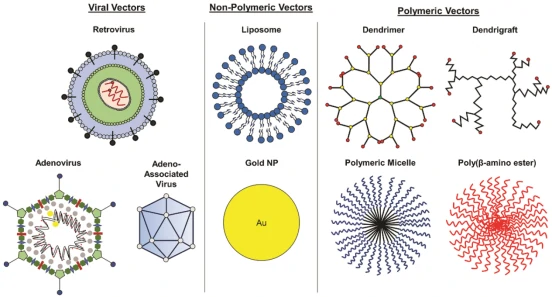
图2. mRNA的载体类型
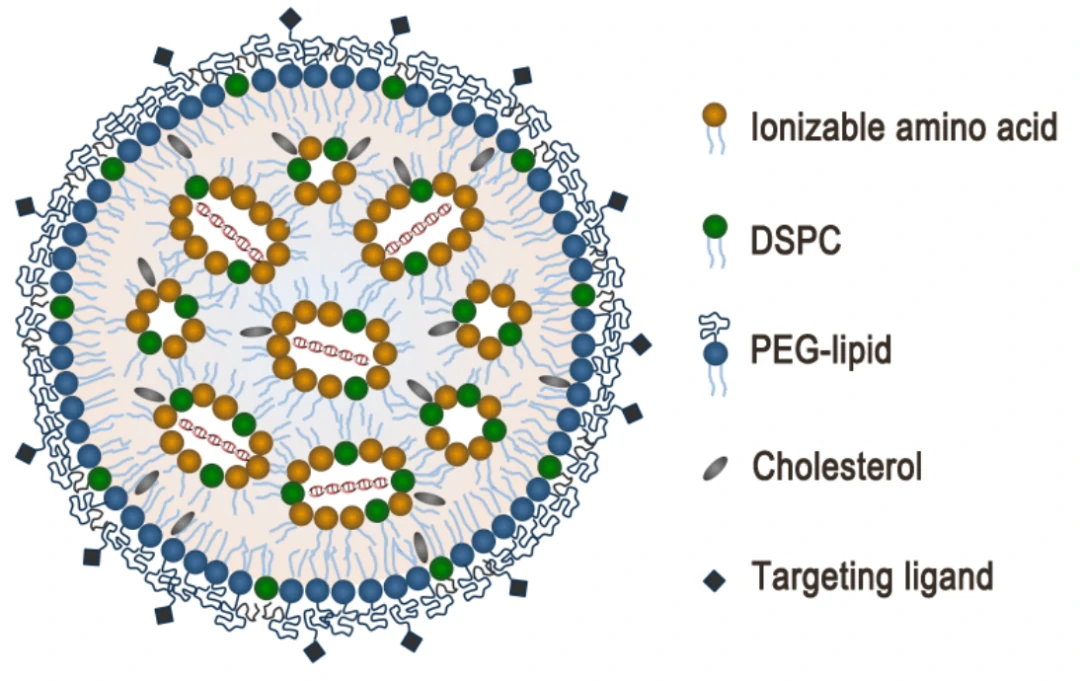
图3. mRNA LNP结构示意图
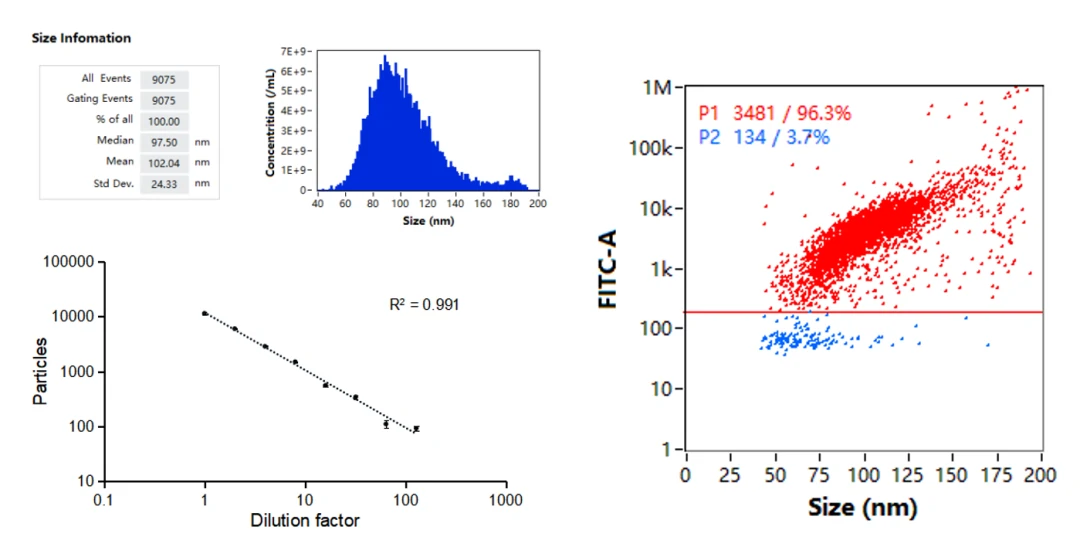
图4. 纳米流式检测仪对mRNA LNPs分析
二、mRNA-LNP与免疫系统
免疫系统作为机体执行免疫应答及免疫功能的重要系统,最基本的功能是识别自己和非己。免疫系统遇到不同形态、大小和表面电荷的物质时,会引发相应的免疫应答。如图5所示,目前已有研究利用mRNA LNPs引发的机体免疫反应,从而清除机体中的肿瘤细胞。但是,药物制剂中若存在过多的游离核酸或者未装载核酸的LNP,则有可能引发免疫系统的过度应答,从而诱发炎症反应,甚至导致超敏反应的发生。为避免这一情况的发生,研究者们通过表面特异性修饰、调整给药途径以及提高装载效率等策略以降低mRNA LNPs可能引发的非必要免疫反应。
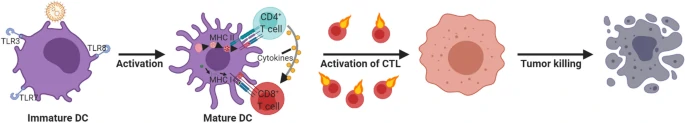
图5. mRNA LNP通过DC细胞杀伤肿瘤细胞的机制

图6. mRNA LNPs(P1)、LNPs空壳(P2)和游离mRNA(P3)同时分析
三、mRNA-LNP与药理学

表2.处于临床阶段的mRNA LNP癌症和传染病疫苗

虽然LNP递送载体极大提高了mRNA的体内递送和表达效率,并在临床中被广泛使用,但是其可能引发的发热、疼痛和肿胀等不良反应也不容忽视。因此,mRNA LNP疫苗和药物的制备和生产工艺仍然需要进一步优化完善,这也对其质量控制和稳定性跟踪提出了更高的要求。
四、总结与展望
LNP同时兼具佐剂和载体的特点,这也使得基于LNP开发的mRNA疫苗展现出了稳定性高、细胞摄取高等优势,在肿瘤和传染性疾病防治中均表现出了巨大的潜力。LNP可能引起的免疫反应作为其药代动力学和安全性的主要标准。由于LNP的化学成分、可能的微生物污染以及其他免疫刺激剂等都是免疫原性的主要决定因素,将影响mRNA递送的药代动力学和药效。因此,在LNP的制备、mRNA包装和质控、成品的稳定性跟踪等各个方面进行实时监测必不可少。
细胞外囊泡(外泌体)是真核细胞和原核细胞分泌的天然存在的纳米颗粒。相比于人工合成的载体,外泌体作为一种天然的纳米药物递送载体具有免疫原性低、较长的体液循环时间和跨越血脑屏障等优势,被认为是理想的新一代药物递送载体(图7)。目前已经有众多案例利用外泌体进行核酸药物的递送。今年美国北卡罗来纳州立大学的程珂教授团队利用人肺球细胞来源的EVs通过电穿孔法装载编码新冠病毒刺突蛋白的mRNA,开发了一种基于外泌体的室温稳定型可吸入冻干粉mRNA疫苗,该疫苗可以在室温环境下至少稳定保存28天。
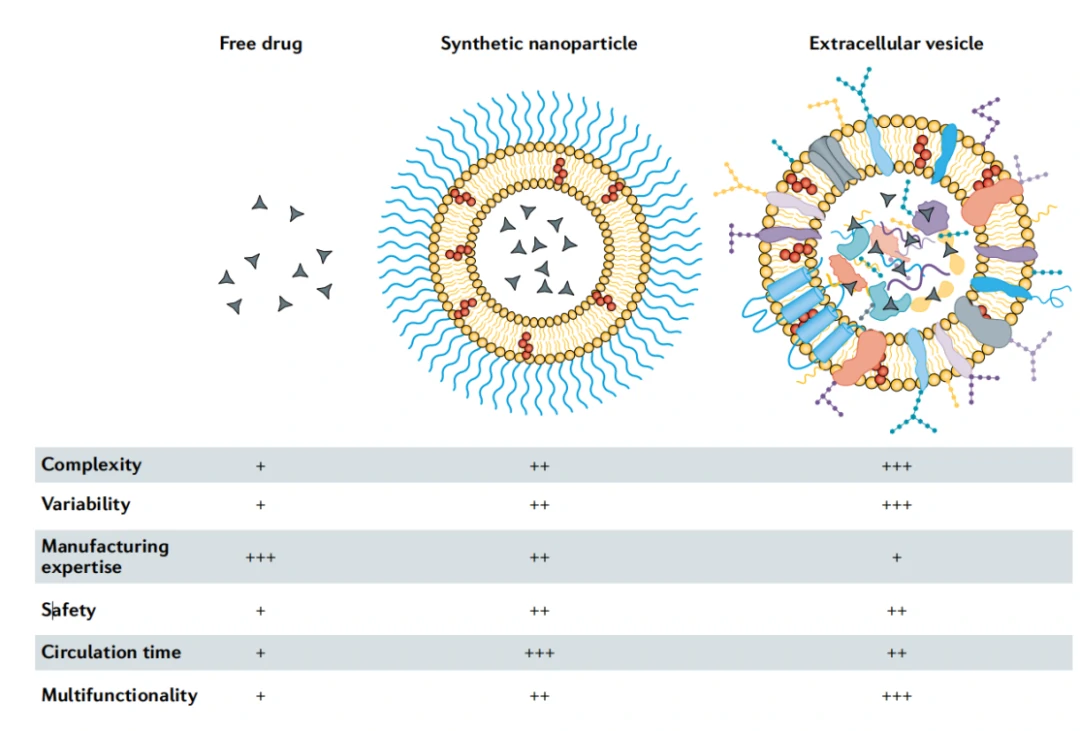
图7. 游离药物,人工合成纳米颗粒和EVs的特征
经过数十年的发展,人工合成的药物在临床上累积了很多失败的教训和成功的经验。合成纳米医学和EV领域之间更多的对话和合作的增加可能会赋能初露头角的EV生物学与合成药物的成功融合。
纳米流式检测仪
纳米流式检测技术作为纳米颗粒多参数表征的重要技术手段,无论在外泌体还是mRNA LNP的综合表征方面都展现出巨大的优势。基于散射光和荧光信号的多参数检测对纳米药物的粒径分布、颗粒浓度、载药比例、载药量以及核酸定位分析的定量表征方法。纳米流式检测仪的应用贯穿整个药物研发、工艺优化、大规模生产、质量控制、稳定性评估等整个过程(图8),为纳米药物的研发和质量控制提供重要的技术保障,这将极大加快核酸疗法的基础研究和临床转化进程。

图8. NanoFCM检测参数
参考文献
1.Kiaie SH et al. Recent advances in mRNA-LNP therapeutics: immunological and pharmacological aspects. J Nanobiotechnology. 2022, 20(1), 276.
2.Witwer KW.et al. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nature Reviews Materials, 2021, 6(2), 103-106.
3.Popowski et al. Inhalable dry powder mRNA vaccine based on extracellular vesicles. Matter, 2022, 5(9), 2960-2974.
4.Tam YY et al. Advances in Lipid Nanoparticles for siRNA Delivery. Pharmaceutics. 2013, 5(3), 498-507.
5.Chen C et al. Quantification of Available Ligand Density on the Surface of Targeted Liposomal Nanomedicines at the Single-Particle Level. ACS Nano. 2022, 16(4), 6886-6897.
6.Zhu S et al. Light-scattering detection below the level of single fluorescent molecules for high-resolution characterization of functional nanoparticles. ACS Nano. 2014, 8(10), 10998-1006.



