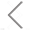冉冉升起的明日之星——外泌体药物递送篇
Author: Mika Huang Date: June 19, 2023
外泌体是由细胞分泌的膜性小囊泡,内含丰富的生物活性分子,且具有将生物活性分子运输到受体细胞的能力,因而在载药领域被广泛研究且热度持续高走。近期,Tenchov等人检索并分析了CAS数据库中外泌体(extracellular vesicles, EVs)在治疗和诊断领域中应用研究的发表情况。如图1所示,有超过4万篇与EV相关的科学论文(主要是期刊文章和专利),其中与EV在药物传递和诊断有关的论文超过25000篇;且2015年后来自美国机构的文献数量与美国国立卫生研究院(NIH)的资助急剧增加,其中,中国、美国、韩国和日本的相关发表期刊文章和专利数量上处于领先地位。
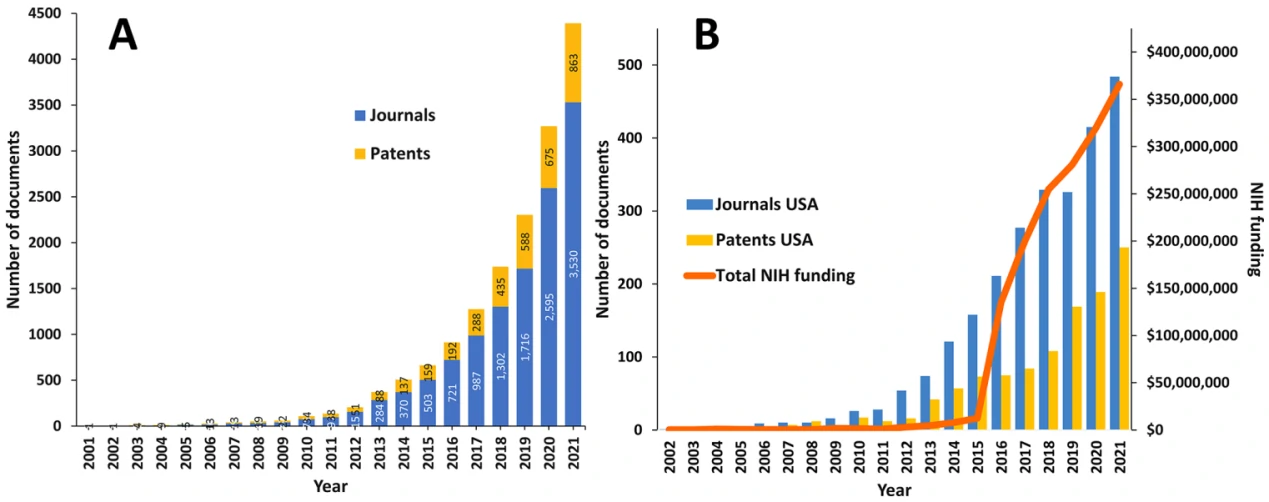
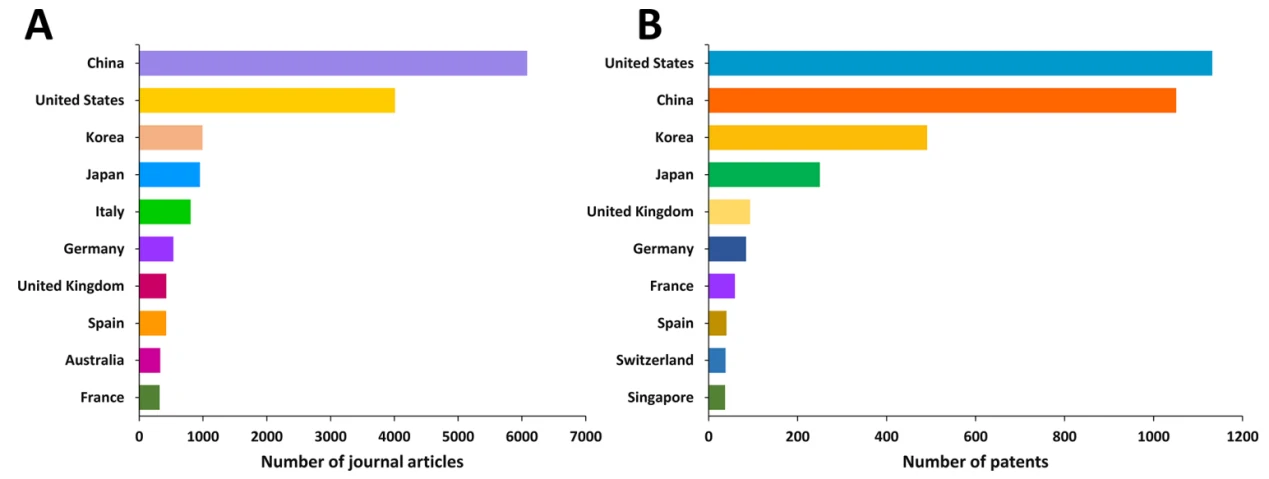
图1. 基于EV载药和诊断的研究论文和专利发表趋势及该领域研究经费与资助项目统计
本期文章,小编将对近年来基于EVs的药物递送的相关基础研究和工业发展进行简单综述与回顾。
药物递送:EV向左,LNP向右?
自上世纪90年代以来,合成纳米颗粒逐渐被应用于临床给药,以满足降低药物副作用和/或提高治疗效果的需求。脂质纳米颗粒(lipid nanoparticles, LNPs)已被证实是保护和运输各种药物或者疫苗的有效载体,也促成了LNPs的临床转化。其中,脂质体作为一种早期具有膜结构的LNPs,在小分子、蛋白肽段和核酸等递送方面充分展现了其灵活性和高效性。
除了合成的纳米载体,外泌体为基础的载体系统也引起了基础研究和工业界相当大的兴趣。外泌体作为细胞间通讯的重要信使,它们将生物分子运输到受体细胞的能力使其在药物输送方面极具吸引力。外泌体在大小、形状和结构上与脂质体相似,但具有更复杂的脂质双分子层,包含多达数百种不同的脂质、蛋白质和碳水化合物类型,以及内部货物和表面相关分子。虽然与脂质体类似,但是外泌体具有更高的膜曲度和膜不对称性,被证明更利于与细胞膜间的相互作用;且外泌体表面丰富的膜蛋白在药物递送方面也赋予其更多的可能性。总的来说,相比于人工合成的纳米载体,外泌体在作为递送载体方面具有诸多优势。首先,外泌体衍生于细胞,在药物递送结束后更容易被代谢;其次,外泌体展现了更低的免疫原性,避免引起不需要的免疫反应;此外,外泌体可跨越诸如血脑屏障等其他纳米载体难以逾越的体内屏障。在过去的3到4年间,根据文章发表和专利申请数量,外泌体相比于LNPs在药物递送方面的热度逐年攀升(图2)。
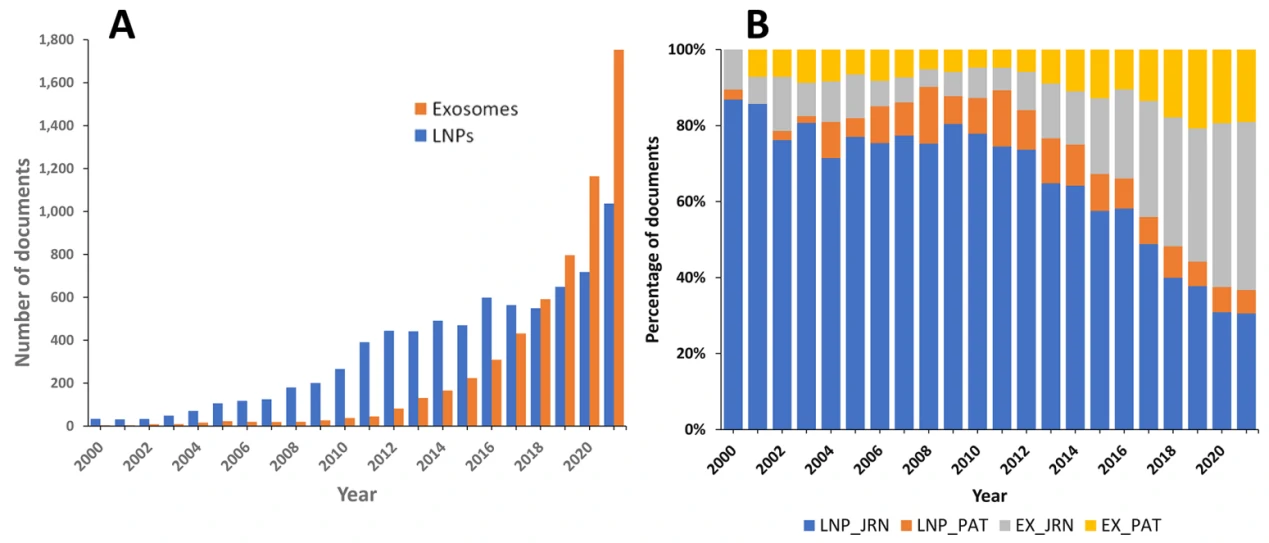
图2. 外泌体和LNPs应用于药物递送的研究进展
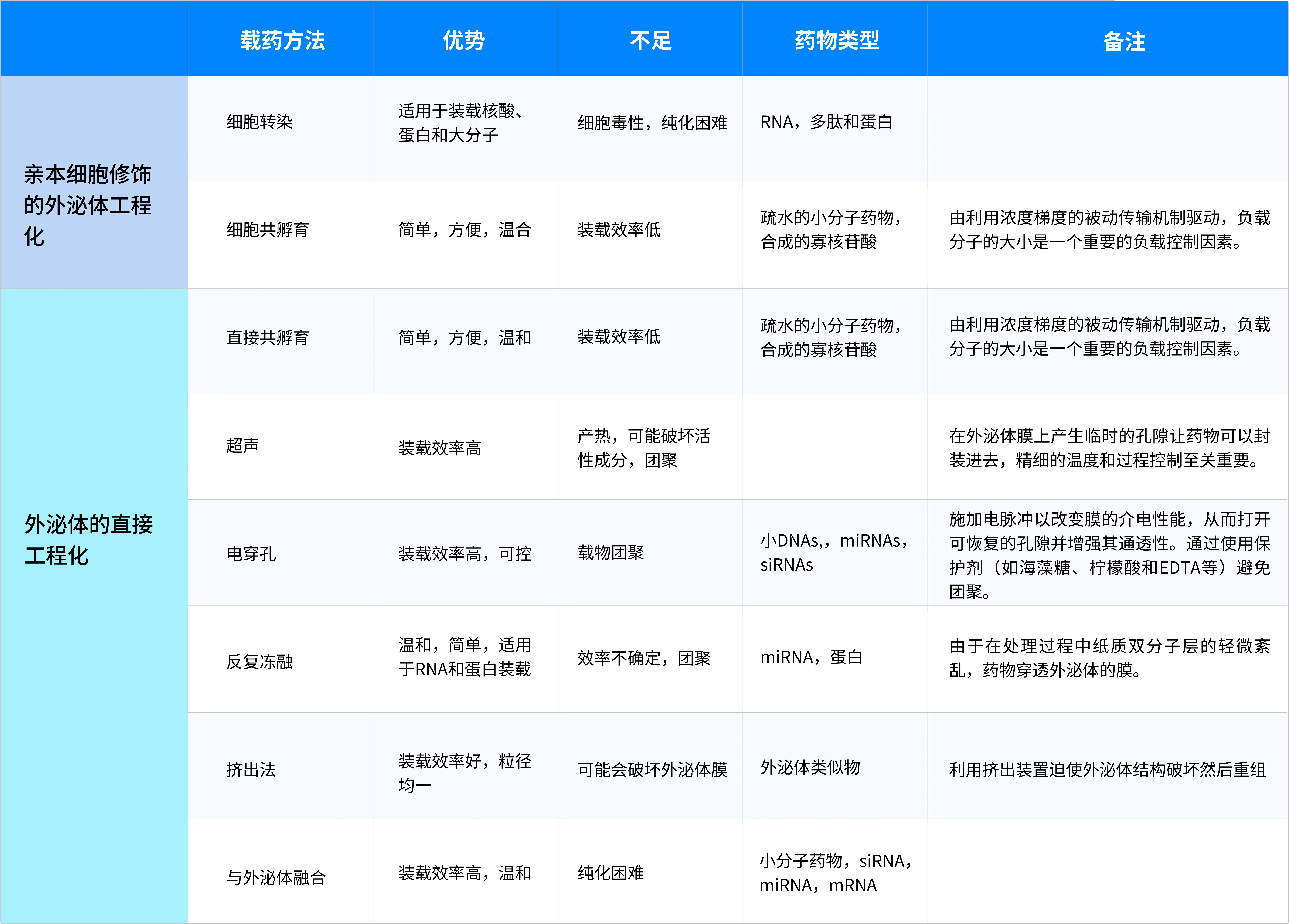
载药方法:亲本细胞修饰 or EV工程化
近年来,已经有多种外泌体载药和修饰平台的相关报道,用于小分子、核酸类以及蛋白肽等药物分子的装载。这些递送系统在靶向性、安全性和药代动力学方面均表现出了巨大的优势。目前基于外泌体的递送平台主要分为两大类(详见下表1)通过亲本细胞修饰的外泌体工程化
通过亲本细胞修饰的外泌体工程化
采用基因工程、代谢标记和外源导入等策略对亲本细胞进行特异性修饰,从而使得这些细胞分泌的外泌体携载自己的目标分子
外泌体的直接工程化
在分离和收集外泌体后采用孵育、超声、电穿孔、反复冻融、挤压以及脂质体融合等技术,在外泌体表面或者内腔修饰和装载所需药物或者靶向试剂
表1. 不同载药方法对比
通过亲本细胞修饰的外泌体工程化
a 基于细胞基因改造的外泌体工程化
基因工程作为细胞修饰策略中一项最为成熟的技术,在外泌体的修饰之中被广泛应用。目前,exoIL-12作为全球首个完成Ⅰ期临床的工程化外泌体候选药物,即是基于Codiak Biosciences公司的engEx™外泌体药物递送平台开发成功。该平台通过对亲本细胞的基因改造,从而实现其来源外泌体的药物递送和蛋白表达,并靶向到特定的组织与器官起到治疗作用。Codiak成功筛选到PTGFRN这一几乎在所有外泌体中均高表达的蛋白。通过基因工程手段将IL-12和PTGFRN融合表达,实现外泌体对IL-12药物的高效装载。该方法实现了IL-12肿瘤微环境的定向递送,增强了IL-12的剂量,并减少IL-12的全身暴露,有效激活人体免疫系统对肿瘤的免疫反应。此外,全球领先的制药公司阿斯利康也基于NanoFCM平台筛选得到了TSPAN14和CD63两个骨架蛋白,用于其外泌体载药平台的开发(详见往期文章:最新:福流助力Codiak公司外泌体候选药物exoIL-12进入临床I期)。
此外,来自美国俄亥俄州立大学、梅奥医学中心以及中国 吉林大学的研究者们对经质粒DNA转染的细胞通过局部瞬间电刺激,促进携带mRNA和靶向肽的外泌体的大量释放。与其他外泌体生产策略相比,细胞局部电刺激穿孔方法使得外泌体产量提高了50倍,携载的mRNA含量增加了1000倍。进一步研究发现,该mRNA高载量的外泌体可恢复原位磷酸酶和PTEN缺陷的胶质瘤小鼠的肿瘤抑制功能并增加了小鼠的生存率。哈佛大学医学院和加州巴克老化研究所的研究人员通过细胞中和外泌体中富集的miRNA的序列分析,并结合RNA结合蛋白等的实验验证,系统性的阐释了miRNA分选进入外泌体的具体机制。研究发现miRNA通过添加特定的核酸序列并与相对应的RNA结合蛋白识别,促进在外泌体中富集并进而调控受体细胞功能的可行性。基于该调控机制,作者通过基因工程的方法在不同miRNA上引入该序列,结果显示这些miRNA在外泌体中的含量上调可高达20倍。该项研究将极大的推动外泌体作为核酸类药物递送载体的发展。
b 基于细胞代谢标记的外泌体工程化
代谢标记是一种完善的细胞功能化策略,它规避了遗传操作的许多问题。可通过向细胞培养基中添加非天然代谢物(如氨基酸、脂类、寡核苷酸或聚糖)来劫持细胞生物合成。这些代谢物被细胞吸收,并分别整合到细胞的蛋白质、脂质、基因以及糖类等物质中。因此,外泌体可在其形成和分泌过程中,实现这些代谢标记产物的携载。美国塔夫斯大学研究者们通过细胞代谢标记的方法实现EVs的工程化改造。研究者们将非天然氨基酸L-azidohomoalanine作为甲硫氨酸的替代品插入到细胞蛋白之中,以及利用N-azidoacetyl-D-mannosamine糖前体在唾液酸中引入叠氮基团。另外,来自厦门大学杨朝勇教授团队开发了一种基于核酸适配体蛋白标记以及聚糖代谢标记的双重标记策略,实现了外泌体表面PD-L1糖基化的原位成像,使得其生物学功能研究成为可能。利用这一策略,首次证实外泌体表面PD-L1的糖基化是其与PD-1蛋白作用的必要条件,并可参与抑制CD8 T细胞的增殖。
c 基于细胞外源导入的外泌体工程化
通过向细胞中引入外源材料,随后可以将其包装于外泌体之中。而该方法一般需要高的纳米颗粒浓度和较长的孵育时间来最大限度地提升细胞所负载的纳米颗粒含量,从而提升在外泌体中的载量。例如,德国细胞生物学和神经生物学研究所的研究人员使用0.5 mM超顺磁性氧化铁纳米颗粒(SPIONs)与神经元细胞孵育24小时,以从神经元细胞培养物中产生负载该纳米颗粒的外泌体。Silva等人利用将巨噬细胞强大吞噬功能这一特点,将巨噬细胞与氧化铁纳米颗粒和小分子光敏剂孵育,用以产生磁性和光学响应的外泌体。Lee等人则使用膜融合脂质体将疏水的有效物质运送到细胞质膜,将亲水物质运送到细胞质中,进而采用该细胞收获得到所需的外泌体。有趣的是,研究者们发现输送到细胞的脂质含量与可运输到外泌体中的脂质含量不成比例。
外泌体的直接工程化
a 基于电穿孔的外泌体工程
早在十年前,牛津大学Matthew J A Wood教授团队即采用电穿孔的方式将siRNA装载于外泌体之中,并采用基因工程的方法将靶向大脑组织的RVG肽段与外泌体高丰度蛋白Lamp2b融合表达以提升其靶向能力。通过静脉注射该工程化外泌体,其被特异性地传递到大脑中的神经元、小胶质细胞、少突胶质细胞,并导致特定基因敲除,在阿兹海默症的治疗中发挥了优异的效果。且研究者没有观察到该工程化外泌体在其他组织的特异性富集。来自美国安德森癌症中心的Raghu Kalluri教授团队同样采用电穿孔的方法将siRNA导入到外泌体和脂质体中,并首次对比了这两种载体在递送和治疗胰腺癌中的优劣性。研究发现外泌体含有可能增强内吞作用的跨膜和膜锚定蛋白,从而促进其内容物的递送;此外,表达于外泌体表面的CD47蛋白可有效避免循环系统中的巨噬细胞对其进行清除,极大增加了其体液循环时间。此外,北卡罗纳大学Cheng Ke教授团队也通过电穿孔方法在肺细胞来源的外泌体、HEK293T细胞来源的外泌体和人工合成的脂质体中分别装载mRNA分子,并比较了三种载体在成为新冠病毒mRNA疫苗的差异。
b 基于超声/挤压的外泌体工程化
如何在外泌体中装载足量的药物分子,一直是该领域一项亟需解决的瓶颈问题。来自厦门大学颜晓梅教授和集美大学陈超翔副教授团队开发了一种主动载药的外泌体药物分子装载策略,实现了阿霉素分子的高效且稳定的外泌体包封。与被动装载方法相比较,该方法的载药量提高了10倍以上。通过NanoFCM技术确认了只有脂膜包裹的颗粒具有阿霉素分子的负载,而其中的主要杂质酪蛋白几乎不含有阿霉素分子。这些发现也进一步激发了基于脂质探针和免疫介导的磁分离技术,选择性地去除非脂质封闭颗粒和酪蛋白组合的污染物。(详见往期文章:JEV:牛奶外泌体载药新突破)
c 基于外泌体+脂质体融合载药
来自于中山大学和耶鲁大学的研究者们则将脂质体与外泌体进行融合,在保留外泌体天然活性的同时,兼具了脂质体成熟的高效药物分子装载。研究者们首先利用基因工程的方法,在外泌体表面高表达CD47蛋白,提高其免疫逃逸能力,同时利用热敏脂质体装载抗癌药物,将两者进行融合,用NanoFCM测定融合效率高达95.7%。这种策略构建的工程化外泌体既能避免被机体免疫清除,同时又高效装载了治疗药物。(详见往期文章:NanoFCM助力新型抗癌药物研发)
外泌体药物递送的工业发展
外泌体在药物递送方面所展现的巨大潜能,使得其日渐成为工业界的宠儿。大量涉及大型制药公司的交易表明,制药行业正在将外泌体作为一种克服目前核酸疗法难以运输至某些组织的手段。
仅在2020年6月份,礼来、武田和拜耳就宣布了涉及外泌体科技公司的超过10亿美元的交易。此外,近年来涌现了几家新公司,专注于开发治疗性外泌体,作为蛋白、基因和RNA治疗等的传递载体。据不完全统计,近些年涌现出来的外泌体领域相关的新兴创业公司有近100家。位于美国马萨诸塞州剑桥市的Codiak BioSciences是第一家把工程化外泌体疗法推向人体临床试验的单位,这家公司有两款产品进入临床试验:一项是exoSTING在外泌体的腔内装载了STING(一类干扰素IFN的刺激基因)激动剂用于治疗晚期实体瘤;另一项exoIL-12则是将外泌体进行工程化修饰,使其在表面展示IL-12,用于治疗早期皮肤T细胞淋巴瘤。虽然Codiak公司已于今年3月申请破产,但它作为外泌体行业先驱,为外泌体大规模生产、纯化工艺和表征质控等行业难题的解决,奠定了重要的基础,对外泌体行业的贡献不言而喻。
除了生物科技公司和药企巨头之外,近两年来众多的供应商也持续发力,频频达成多个重磅战略合作。CDMO全球霸主LONZA集团先后收购了Exosomics的服务单元和Codiak的外泌体生产工厂,积极布局外泌体服务,已形成意大利Siena、瑞士Basel、美国得克萨斯州Houston、马里兰州Rockville和马萨诸塞州Lexington等多中心的服务网络。RoosterBio作为行业领先的MSC和外泌体技术平台供应商,分别与赛多利斯、NanoFCM、Univercells及ShiftBio等达成合作。国内方面,中国企业蓄势以待,2015年前后中国外泌体企业如雨后春笋般纷纷成立,资本更是频频出手,多家企业对外公布融资情况。
截止目前,纳米流式检测技术已经进入由中国研究型医院学会细胞外囊泡研究与应用分会围绕SC-EVs制定的两项全国团体标准中,以及由上海市生物医药行业协会依据协会制定的《间充质干细胞外泌体质量控制标准》(T/SBIAORG 001-2023)团体标准中,期待未来在解决外泌体大规模生产、纯化工艺和表征质控的难题,为行业提供完整的解决方案。
展望
外泌体已被证明其在药物递送方面的巨大潜力,且该领域产业发展的如火如荼。但是相比于病毒和脂质纳米颗粒等日趋成熟的递送载体,外泌体药物递送的发展也才近10年的时间,外泌体载体的商业化之路仍然任重而道远。这需要更多的临床相关系统评估,并与脂质体等替代方案进行直接、定量的比较,以全面评估风险-效益比。在此过程中,越来越多的新分析技术有望为外泌体的独特性提供新的见解,并可能激发下一代递送系统的设计与开发。
参考文献
-
Kenneth W. Witwer and Joy Wolfram et al., Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nature Reviews Materials, 2021, 6, 103-106.
-
Rumiana Tenchov, Janet M. Sasso, Qiongqiong Angela Zhou et al. Exosomes—Nature's Lipid Nanoparticles, a Rising Star in Drug Delivery and Diagnostics. ACS Nano 2022, 16, 17802−17846.