核酸疗法——递送系统成关键
Author: Mika Huang Date: December 23, 2021
近年来,核酸疗法取得多项突破性成果,已成为全球投资新风口和生物制药巨头的必争之地。2020年新冠疫情全球大流行,mRNA核酸疫苗横空出世,成为核酸疗法领域的黑马,打开了一个新的百亿赛道。与此同时,它也把核酸疗法推上了一个前所未有的高度,核酸疗法进入快车道。核酸药物有望成为继小分子化药和抗体药后的第三大类型药物,而递送系统仍然是核酸药物绕不开的关键话题。
本期内容主要介绍核酸疗法实现临床转化的关键——递送系统的相关内容,其中包括递送系统的选择、质量控制及常用的表征手段。同时以几家核酸疗法领域的头部企业为例,介绍纳米流式检测仪(NanoFCM)优化核酸药物递送系统的研究思路,希望能给核酸疗法领域的研究者们一些启发。
核酸疗法从基础研究迈向临床
2018年,美国Alnylam制药公司开发的Patisiran(商品名:Onpattro)获美国食品药品监督管理局(FDA)和欧盟委员会(EC)批准上市,用于治疗转甲状腺素蛋白淀粉样变性(hATTR)引起的神经损伤,这是全球首个获批上市的RNAi药物。2020年,瑞士诺华的Inclisiran(商品名:Leqvio)被欧盟委员会批准上市,用于治疗成人高胆固醇血症及混合性血脂异常,标志着核酸疗法从罕见病治疗拓展到慢性病治疗领域,具有里程碑式的意义。
近年来,越来越多的核酸疗法(表1)获批,证明了通过靶向体内遗传信息实现疾病治疗的巨大潜力。由于传统的治疗方法通常针对的是蛋白质而不是根本的基因问题,其一般只能产生短暂的治疗效果。而核酸疗法可以通过基因抑制、添加、替换或编辑,达到长期甚至治愈的效果。
表1. FDA和EMA批准的核酸疗法[1]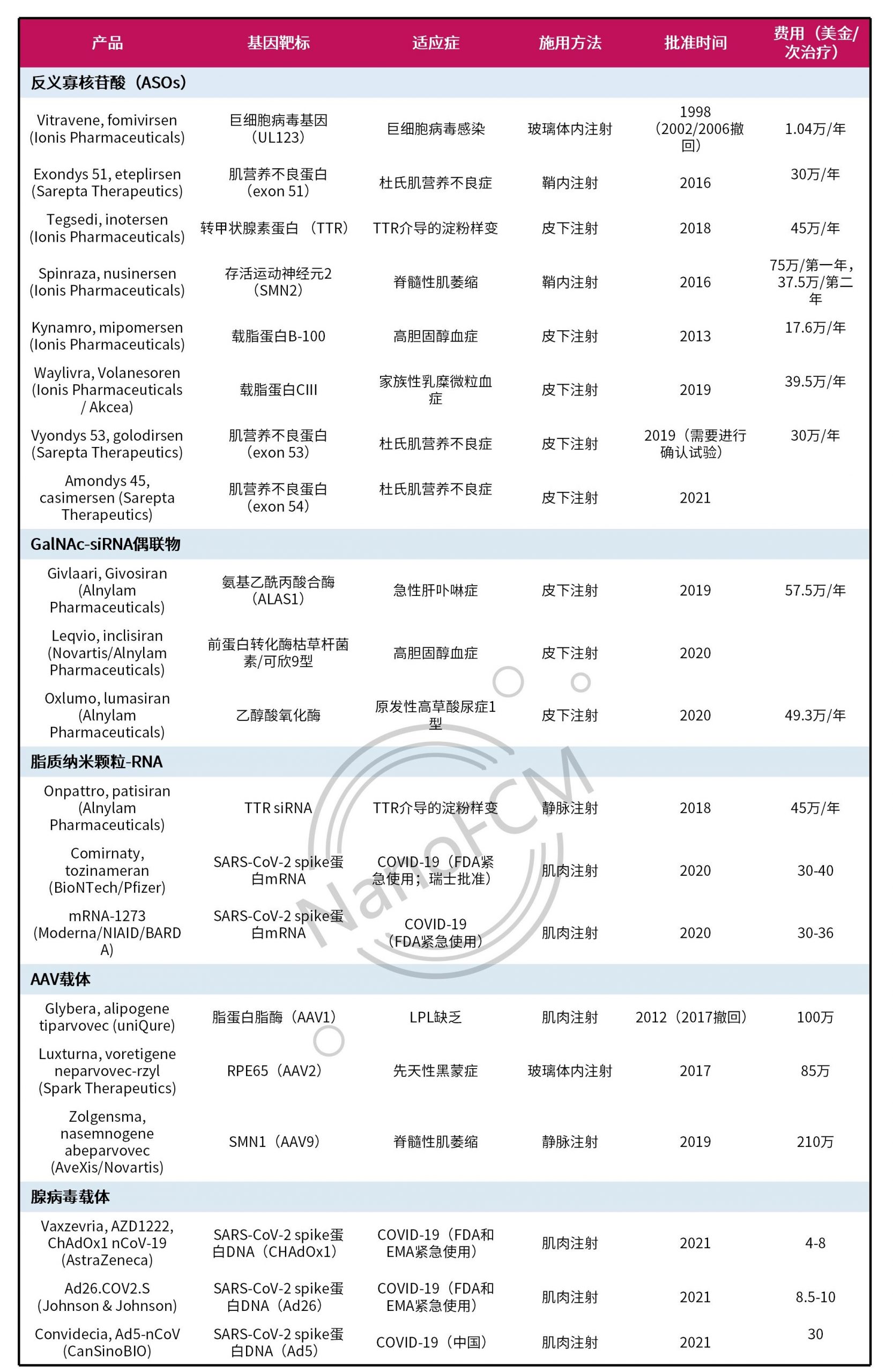
核酸药物临床转化的关键—递送系统
核酸药物进入细胞面临两大挑战,一个是RNA暴露在血液中容易被血浆和组织中的RNase酶降解,而且会造成免疫原性;另一个是带负电的RNA难以跨膜进入胞内。
目前比较主流的核酸疗法常用以下几种递送平台技术[1],分别是反义寡核苷酸(Antisense Oligonucleotides,ASOs)、N-乙酰半乳糖胺(GalNAc)配体修饰的短干扰RNA(siRNA)偶联物(GalNAc−siRNA conjugates)、脂质纳米颗粒(Lipid Nanoparticles,LNPs)和腺相关病毒载体(AAV vectors)(图2)。外泌体作为核酸递送领域的“后起之秀”,也是核酸递送平台的“种子选手”。
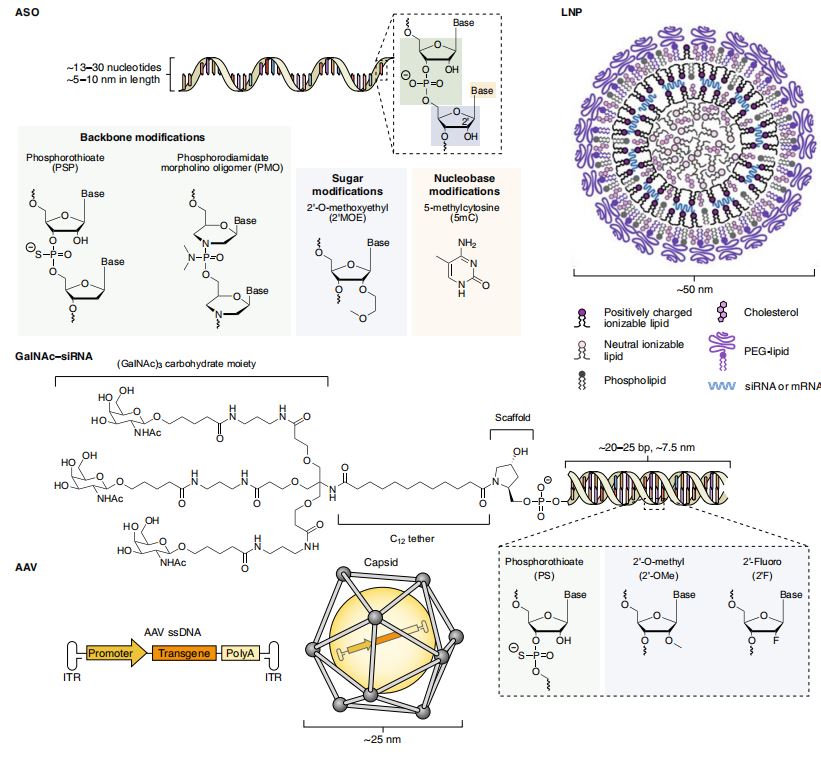
图1. 四种核酸疗法常用的递送技术[1]
这些递送技术得以临床转化的原因主要有以下两个:一是化学修饰技术,通过改造核酸分子提高其稳定性,并避免免疫系统的识别;另一个是递送载体,递送载体可以使核酸免受血清核酸酶活性和免疫成分的影响,而且可以决定药物的生物分布。这其中更为关键的是递送载体的开发,RNAi制药领域的生物技术公司以及该领域的科研工作者从未停止新的递送技术探索,重点聚焦在GalNAc偶联和LNPs技术的研发和应用上,LNP是目前核酸类药物应用最多、最为成熟的递送系统之一。
递送系统的质量控制
核酸药物在体内的行为是由其各种理化性质决定的,包括载体材料的组成和性质、粒径及分布、结构及形貌、表面电荷、亲疏水性、颗粒浓度、载药量、载药比例、表面配体的种类及密度等。对这些理化性质进行准确的表征有助于核酸药物的设计、研发及质量控制。
核酸药物定量分析方法的建立对于药物的质量监控至关重要,好的分析方法可以保证药物在研发、生产和临床使用中的安全性和有效性。作为一种单颗粒水平的快速多参数定量表征方法,纳米流式检测技术可对核酸药物进行粒径分布、颗粒浓度、包封率、载药量、表面配体密度等多参数的综合表征。
1.siRNA LNPs
携载siRNA的脂质纳米粒是目前临床证实具有潜力的RNAi药物,但是纳米药物的颗粒浓度和有效装载siRNA脂质纳米粒(LNPs)的比率这两项指标目前尚缺乏有效的表征手段,由于空载与装载了siRNA的脂质纳米颗粒在粒径分布、形状和密度上均非常类似,即便采用价格极其昂贵的冷冻透射电镜(每个样本的测试费高达几百欧元)仍然无法确认脂质纳米颗粒是否成功装载了siRNA。纳米流式检测仪对Alnylam制药公司用于治疗肝病的纳米药物进行了多参数表征(图2),结合核酸染料染色,建立了单颗粒水平siRNA-LNP的粒径、浓度、载药比率和平均载药量的定量表征方法。
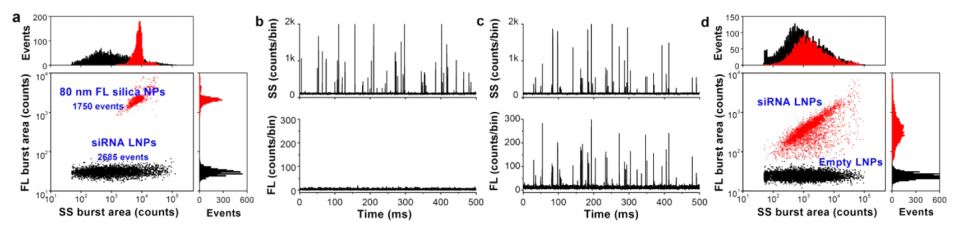
图2. 纳米流式检测仪对siRNA纳米药物的综合表征[2]
2.mRNA LNPs
mRNA新冠疫苗(辉瑞/BioNTech)从研发至获批上市仅用时327天。疫苗成为了mRNA 技术成功应用的首个成果,也成就了LNPs应用领域的突破式进展。Moderna开发的mRNA 疫苗(mRNA-1273,Moderna)在新型冠状病毒的基因序列发布后一个月内就被设计并合成出来,其传染病前主管 Giuseppe Ciaramella 曾称赞LNPs为整个事件的“无名英雄”。相比于传统疫苗,mRNA疫苗生产工艺简单、开发速度快、无需细胞培养、成本低。结合核酸染料标记的方法,通过NanoFCM即可快速确定空载和装载mRNA的LNPs(图3)。NanoFCM可测定mRNA LNPs的粒径分布、颗粒浓度、均一性及包封率等多个参数,从而对mRNA LNPs的生产、包装条件优化及质量控制提供指导意见。
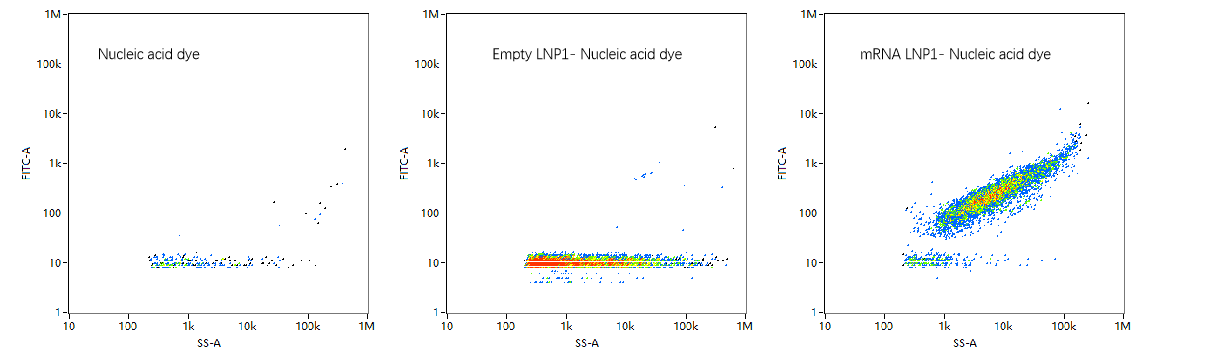
图3. 纳米流式检测仪表征mRNA-LNP的装载比率
因为mRNA本身是带负电的,会受到同样带负电的细胞膜的“同性相斥”,所以研究人员采用带正电的脂质分子来帮助LNP进入细胞。这种带正电的脂质分子有一定的毒性,可能会导致细胞膜损伤,引起毒副作用。所以靶向递送到特定组织和器官将是LNP领域接下来的发展方向。
3.外泌体
2011年,牛津大学的Matthew Wood团队证明外泌体可以跨越小鼠的血脑屏障,将携带的siRNA传递到小鼠的脑部,降低阿尔兹海默症相关蛋白BACE1的表达,外泌体作为核酸疗法的载体开始大放异彩。2021年11月30日,Codiak公司宣布了其开发的exoASO-STAT6获美国FDA批准,正式进入临床开发阶段,这是核酸递送领域一个新的里程碑事件。exoASO-STAT6是Codiak公司开发的第三款进入临床试验的工程化外泌体治疗候选药物,在外泌体表面负载特定序列的ASO,并将其递送至高度免疫抑制型的巨噬细胞(M2型),降低免疫抑制转录因子的表达,促进抗肿瘤免疫反应。
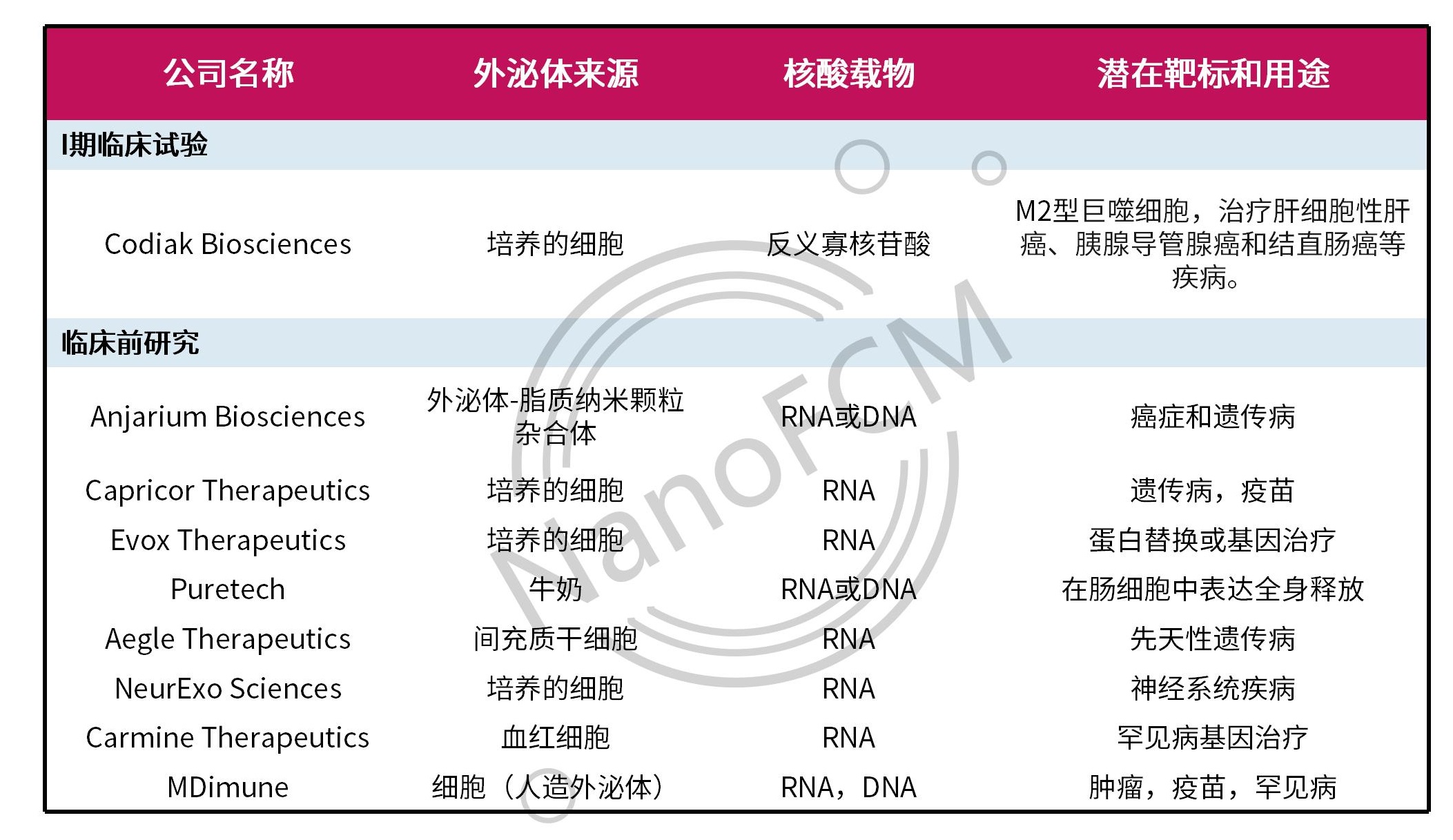
无独有偶,另外一家外泌体领域的领军企业Evox Therapeutics也开发了基于外泌体的核酸递送平台——CORRECT,用于递送包括mRNA、siRNA、反义寡核苷酸以及CRISPR等治疗制剂。Evox在2020年分别与武田制药(Takeda)和礼来公司(Eli Lilly and Co.)达成了9亿和12亿美元的合作协议,用于开发治疗罕见病和神经系统疾病的RNA药物。此外,Anjarium Biosciences、Capricor Therapeutics和PureTech Health等众多创业公司采用不同的工程化策略,载入不同的核酸药物。下面的表格列举了几例有代表性的外泌体核酸递送项目。
表2. 具有代表性的外泌体核酸递送项目
虽然外泌体作为核酸治疗的载体还没有成熟的产品问世,但外泌体具有人工合成的载体无法比拟的低免疫原性、生物相容性以及稳定性等优势,且可以通过基因工程的手段对其进行定向改造,使其携载特定药物的同时具有靶向特定器官的功能。相信假以时日,外泌体载体必定为核酸疗法带来重大的变革。
4.其它载体
除了以上介绍的LNPs递送系统外,现在还有很多企业开发出了新的递送系统,比如斯微(上海)生物科技有限公司开发的LPP(lipopolyplex)纳米递送平台和圣诺制药的多肽纳米(PNP)药物递送系统等。不管是采用哪种递送载体,都可以通过NanoFCM对其粒径分布、包封率和载药量等参数进行综合表征。此外,除了非病毒载体,近年来,病毒介导的基因治疗受到广泛关注。与其他病毒相比,腺相关病毒(AAV)载体因具备安全性好、宿主范围广、免疫原性低和表达稳定等优点,已成为多种人类疾病治疗的理想基因传递工具。关于AAV载体的综合表征取得了哪些突破式进展呢?小编先在这里卖个关子,感兴趣的朋友可以关注厦门福流生物科技有限公司微信公众号后续的专题报道,敬请期待~
总结和展望
核酸疗法的研发经历了漫长的发展历程,化学修饰和递送系统等关键技术的突破在核酸疗法的产业化中发挥了重要的作用。通过选择较好的药物递送载体以及采用靶向修饰等策略,超级药物核酸疗法将引领创新药进入新时代。
纳米流式检测仪可在单颗粒水平,对7-1000 nm的颗粒进行综合表征。基于散射光和荧光信号的多参数检测建立了核酸纳米药物的粒径分布、颗粒浓度、载药比例和载药量分布的定量表征方法,可对核酸纳米药物的生产过程进行质量控制,优化生产条件、提高载药效率。纳米流式检测仪的应用贯穿整个药物研发、生产、质控、稳定性评估等整个过程,为核酸纳米药物的研发和质量控制提供重要的技术保障,这将极大加快核酸疗法的基础研究和临床转化进程。
参考文献
- Kulkarni, J.A. et al. “The Current Landscape of Nucleic Acid Therapeutics.”Nature Nanotechnology, 2021,16(841):630-643.
- Zhu S.B. et al. “Light-Scattering Detection below theLevel of Single Fluorescent Molecules for High-Resolution Characterization of Functional Nanoparticles” ACS Nano, 2014, 8(10):10998-11006.