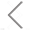Science Advances|基于原位EV-miRNA的肿瘤液体活检新技术
Author: Mika Huang Date: November 28, 2023
MicroRNAs(miRNAs)是一类短的、非编码的单链RNA(约22个核苷酸),通过抑制靶基因的翻译或降解其靶转录基因,在基因表达调控中发挥重要作用。细胞外囊泡(extracellular vesicles, EVs)是一种通过多囊泡体途径产生的膜性小囊泡,miRNAs可被选择性地封装和富集在外泌体中,在磷脂双分子膜的保护下保持稳定,具有广泛的生理和病理过程的调节作用。肿瘤来源的外泌体miRNA与癌症进展密切相关,为提高miRNA液体活检的准确性带来了较大的希望。然而,由于复杂的背景干扰、EV的高异质性以及不同外泌体miRNAs的表达水平差异较大。同时,生物标志物的非特异性也增加了miRNAs作为诊断工具的难度,肿瘤源性外泌体的特异性识别和外泌体miRNAs的定量检测面临巨大挑战。因此,亟需开发一种灵敏、准确和简便的方法用于检测复杂样本中肿瘤外泌体miRNA。
上海交通大学医学院分子医学研究院杨朝勇教授团队及其合作者们在Science Advances杂志发表了题为“Simultaneous subset tracing and miRNA profiling of tumor-derived exosomes via dual-surface-protein orthogonal barcoding”的论文。该研究报道了一种基于肿瘤外泌体的双表面蛋白正交识别的miRNA原位分析的方法(SORTER),用于肿瘤来源外泌体中miRNA的原位分析。

如图1所示,该操作流程主要由以下三部分组成,包括样品收集和血浆制备、基于SORTER的肿瘤外泌体miRNA原位分析以及基于生物统计学的结果分析用于癌症诊断。其中,SORTER包含了肿瘤EVs的条形码标记、miRNA检测探针的导入和miRNA的原位分析。

图1. 基于SORTER检测肿瘤源性EVs追踪和原位miRNA检测示意图
肿瘤源性EV条形码标记及检测
如图2A-C所示,通过CD63-S-L(FAM)和EpCAM-S-L(Cy5)适配体对前列腺癌细胞(LNCaP)和良性前列腺增生来源(BPH-1)的EVs表面的CD63和EpCAM分别进行标记,并使用荧光显微镜和NanoFCM对其进行表征分析。成像结果中,CD63(绿点)和EpCAM(红点)来源于同一个LNCaP Exo,而在BPH-1 Exo中只检测到少量的荧光信号共定位。纳米流式(NanoFCM)检测结果也揭示了EpCAM-S-L 在LNCaP Exo上的标记效率(74.5%)明显高于BPH-1 Exo(2.5%)CD63-S-L 在LNCaP Exo上的标记效率(45.7%)明显高于BPH-1 Exo(2.4%)。表明CD63和EpCAM蛋白在单个肿瘤源性EV表面共表达,CD63和EpCAM可以在同一EV表面有效标记。
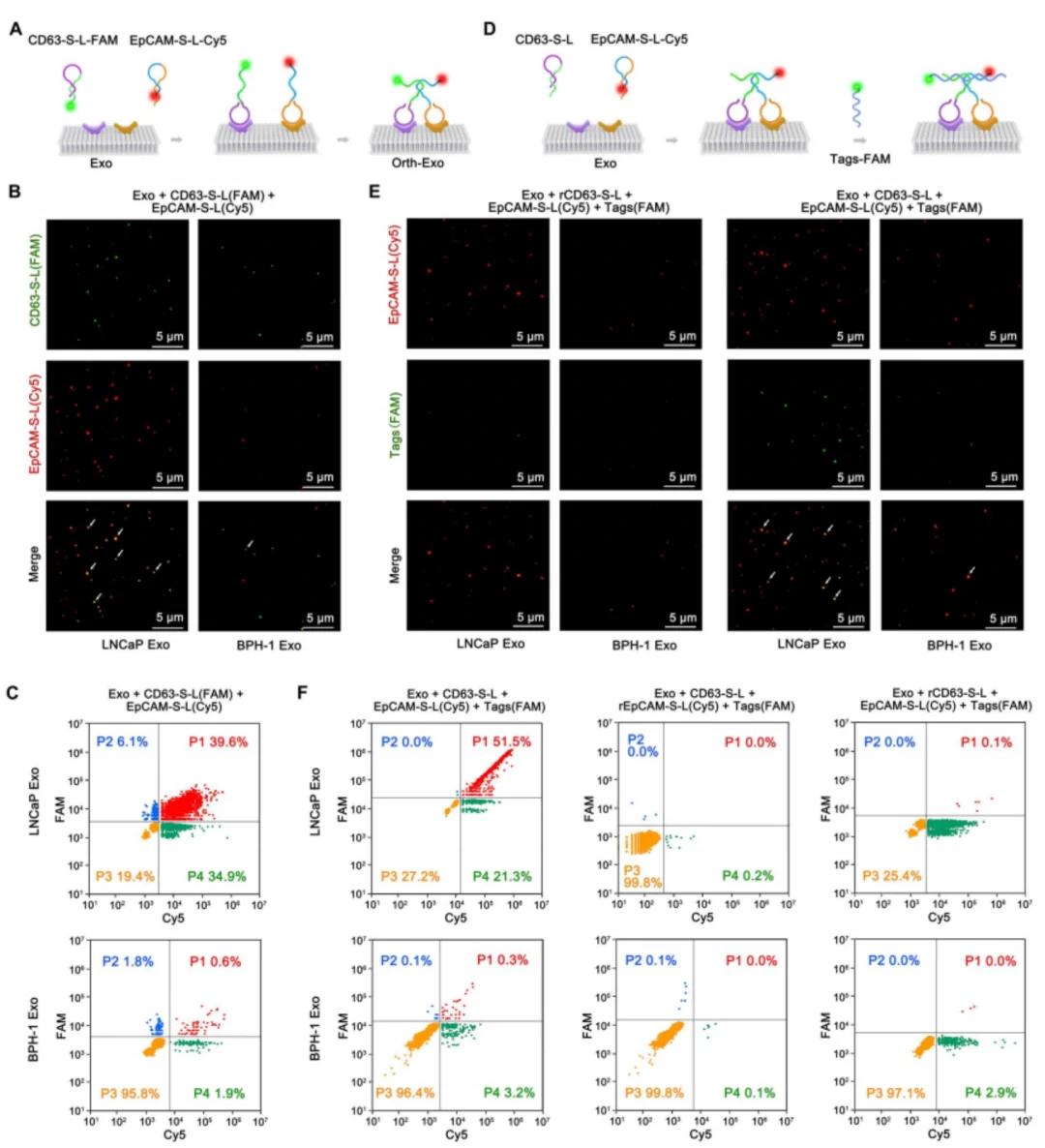
图2. LNCaP Exo和BPH-1 Exo标志蛋白分析
同时,为了考察肿瘤EVs上的正交条形码和脂质体上的锚定探针的互补性,作者同样通过荧光显微镜和NanoFCM对CD63-S-L、EpCAM-S-L(Cy5)和DNA Tags(FAM)的标记效率进行分析(图2E-F),结果显示Tags(FAM)在LNCaP Exo上的标记效率明显高于BPH-1 Exo。该结果表明肿瘤源性的EV表面成功形成了正交条形码,并在同一EV表面形成了DNA Tags和正交条形码有效的拉链式杂交。
EV-miRNAs的原位分析
如图3A所示,在表面插入Tag的脂质体中包封可用于检测特定miRNA的功能化Au NFs;在脂质体表面Tag与肿瘤源性EVs上标记的条形码的协助下启动二者的融合,从而导入miRNA检测探针,在内部特定miRNA配对检测后的荧光信号扩增放大。
在此,作者选择了miR-21、miR-10b、miR-182、miR-222、miR-221和miR-1290这6种与肿瘤发生和发展密切相关的EV-miRNA进行原位分析。NanoFCM检测结果(如图3)表明,LNCaP Exo与Tags-Lipo@Au NFs孵育后的荧光信号显著增强,且LNCaP Exo的荧光明显高于BPH-1 Exo(图3B)。这些结果表明肿瘤EVs中miR-21水平显著升高。随后,在PBS和健康血浆中添加不同浓度的LNCaP Exo后,miR-21的荧光信号随浓度添加倍数而增加,具备良好的线性相关性。通过测量三种PCa细胞(PC-3、LNCaP和DU145)和BPH-1细胞衍生的EV中六种miRNA的表达水平验证SORTER的性能,这些miRNA在肿瘤源性EVs中的表达明显高于正常BPH-1外泌体(图3F),且相比于PBS和健康血浆样本,肿瘤源性的EVs荧光强度显著高表达(图3G)。

图3. SOTER对于肿瘤EV-miRNAs的原位分析
临床样本评价
如图4A-C所示,作者进一步对20 名PCa患者和10名BPH的血浆样本中的EVs进行分析,分别采用双表面蛋白CD63+ EpCAM+ EVs、单CD63+ EVs、单EpCAM+ EVs对6个miRNAs进行原位荧光强度分析。在不同的EV亚群中,各miRNA的表达丰度具有相当大的异质性,与BPH血浆样本相比,PCa患者血浆中6种miRNAs均明显上调(图4D)。但是,在对不同亚群EVs中的6种miRNA的两两比较发现其之间的关联性不强(图4E-G)。各标志物的ROC曲线揭示,CD63+ EpCAM+ EVs对PCa和BPH的特征诊断性能最佳,AUC值可达1.000(图4K)。SOTER以100%的灵敏度、特异性和准确性区分PCa患者和BPH正常人(图4M-O)。

图4. SORTER对于肿瘤源性EV-miRNAs的临床评价
综上,作者提出了一种基于双表面蛋白正交标记引导的EV-miRNA原位分析策略(SORTER),以精确识别和分类肿瘤来源的EVs,极大开拓和提高了基于EVs的液体活检的准确性。该方法全程仅需0.2μL血浆样本,耗时不超过2小时,将大大提升外泌体EVs-miRNA在液体活检的临床应用。
在该研究中,NanoFCM基于其卓越的散射和荧光检测性能,结合不同的标记策略,在单外泌体水平实现了不同蛋白marker的标记效率、蛋白的共定位分析、EV-miRNA原位分析等。也再次证明了,NanoFCM技术在EVs液体活检中的巨大应用潜力。