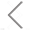TOP-EVs:胞内蛋白质递送平台
Author: Mika Huang Date: December 29, 2023
细胞外囊泡 (extracellular vesicles, EVs) 是活细胞分泌的直径约30~150 nm的具有双层膜结构的小囊泡,因其具备良好的生物相容性、低免疫原性和天然的靶向能力而被视为理想的药物递送载体。然而,如何将治疗药物有效装载至EVs内部以及到达受体细胞后如何有效释放是细胞外囊泡作为治疗性载体面临的首要难题。
目前装载药物在EVs内部的方法总体可以分为两大类
01.外部装载
在分离纯化获得EVs后,通过机械或化学手段暂时打开EVs的膜,使药物进入囊泡中;在早期的推文中,小编报道过不同的外部载药策略及效果的对比(外泌体载药策略:你选对了吗?),基于电穿孔、超声、挤压、冻融等物理方法进行外源性EVs蛋白装载,会一定程度上损害EVs的完整性和蛋白质的活性,这无疑会影响药物的载量和递送效率,同时还会伴随操作流程复杂的问题。
02.内源表达
通过细胞内源表达,使蛋白或RNA等药物被分选进入EVs。蛋白药物通常以共价连接的形式结合在EVs膜上且内体逃逸能力低,使得内源表达策略用于胞内蛋白的递送充满挑战。此前曾有体外实验报导EVs介导的药物递送到达靶细胞的效率不足5%,那么有没有一种既无损又高效的EVs蛋白负载和靶向的技术平台呢?
TOP-EVs
荷兰乌特勒支大学医学中心Lei和Sluijter等多个科研团队紧密合作,尝试探索雷帕霉素相互作用的异二聚体蛋白FK506结合蛋白 (FKBP12) 和T82L突变体FKB12-雷帕霉素结合结构域 (FRB) 的潜力。FKBP12通过N-肉豆蔻酰化序列连接到细胞膜上,FRB则通过GGSGG接头与靶蛋白融合,通过在EV表面修饰融合性水疱性口炎病毒糖蛋白 (vesicular stomatitis virus glycoprotein, VSV-G) 进一步促进EV在受体细胞中的内体逃逸,以提升胞内蛋白的递送。该药物递送平台被命名为TOP-EVs (technology of protein loading through extracellular vesicles, TOP-EVs) , TOP-EVs在体外和体内条件下均可有效地介导多种靶蛋白的胞内传递,有望用于推进蛋白质治疗药物的发展。该成果以题名"TOP-EVs: Technology of Protein delivery through Extracellular Vesicles is a versatile platform for intracellular protein delivery" 发表在Journal of Controlled Release上。
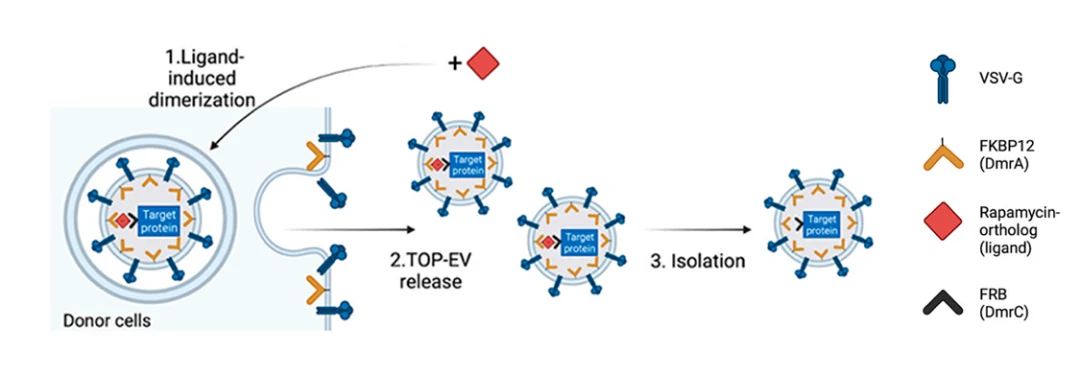
图1. TOP-EVs技术平台示意图
补充:雷帕霉素是一种大环内酯类化合物,最早是从复活节岛土壤中的链霉菌中分离出来,被发现具有抗真菌作用,之后被发现具有免疫抑制功能。FKBP12 (FK506 binding protein 12) 是能与大环内酯类免疫抑制剂FK506和雷帕霉素特异性结合,并在哺乳动物中广泛表达的一类蛋白。
TOP-EVs技术平台
为了实现可控同时可逆的蛋白装载及随后通过EVs的递送,作者整合了融合源性VSV-G和雷帕霉素诱导的异源二聚体T82L突变体FRB (DmrC) 与FKBP12 (DmrA) 融合的靶蛋白。选取GFP蛋白作为模型,作者首先构建了GFP TOP-EVs稳转细胞系,将其暴露在雷帕霉素(配体)环境中,通过共聚焦荧光显微镜确认,孵育24 h后GFP已迁移到细胞核外。随后再探索这个策略能否将GFP有效装载到EVs中。通过在HEK293FT细胞中瞬转GFP TOP-EV质粒,结合VSV-G共转染构建了TOP-EVs细胞系(供体细胞)。随后加入配体,换成无外泌体培养基,通过差速超速离心的方法分离获得EV样品,首先用WB分析定性和(半)定量地验证GFP蛋白的表达情况(图2)。
作者设置了一系列的对照条件(表1)来确认配体和VSV-G是不是TOP-EV平台实现蛋白装载和递送的必要条件。从WB的结果可以判断,在不添加VSV-G质粒共转染的情况下,供体细胞与配体共孵育并不会显著提升GFP的装载量。然而,当供体细胞与VSV-G共转染同时与配体共同孵育时,GFP在EVs的装载量得到显著提升。这个结果提示VSV-G质粒和配体都是GFP装载不可或缺的条件。
表1. TOP-EV平台不同处理方法(+表示添加,-表示未添加)
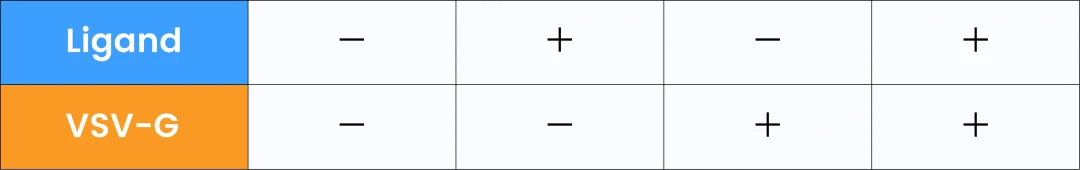

图2. 通过WB定性和(半)定量验证GFP的表达情况
NanoFCM研究GFP装载效率
这些GFP在所有的EVs中是均匀分布的吗?还是仅在某些EV亚群中过表达?这个问题就需要通过单颗粒的手段来解答了。
作者用纳米流式检测仪进一步考察了TOP-EVs平台对GFP的装载效率,如图3A所示,在未添加VSV-G质粒共转染时,不管是否加入配体,负载GFP的EVs颗粒浓度均较低;添加VSV-G质粒共转染之后装载GFP的EVs颗粒浓度明显升高,配体和VSV-G质粒共转染同时发生的情况下GFP装载效率达到66.2%(表2),这与WB的结果一致。采用EVs膜染料MemGlow 640对四种条件下获得的TOP-EVs进行染色,纳米流式检测确认总颗粒浓度和膜染料阳性的颗粒浓度很接近,证明TOP-EVs的纯度非常高。GFP阳性群体和GFP-膜染料双阳群体的浓度几乎相同,说明选用的膜染料MemGlow 640对EVs的标记效率非常高,可以有效标记含有膜结构的颗粒。
此外,GFP阳性群体中含四跨膜蛋白 (CD9/63/81) 的TOP-EVs从11.3% (-/+:配体/VSV-G) 提高到18.6% (+/+:配体/VSV-G) ,GFP阳性率显著高于CD9/63/81的阳性率,表明大部分TOP-EVs是不表达四跨膜蛋白的。从粒径分布图中发现GFP阳性颗粒(绿色)的平均粒径整体大于GFP阴性颗粒(蓝色)的平均粒径(图3D),且TOP-EV (+/+:配体/VSV-G) 的GFP阳性率显著高于TOP-EV (-/+:配体/VSV-G) ,使用纳米流式可以快速揭示EVs粒径大小和功能之间的相互关系。至此可以得出结论,VSV-G质粒共转染和配体诱导的相互作用是促进内源性TOP-EVs蛋白装载和传递的基本条件。
图3. 纳米流式对不同培养条件下TOP-EVs内的GFP装载情况分析
表2. NanoFCM分析GFP装载效率

细胞水平验证TOP-EVs的GFP传递效率
本研究中,TOP-EVs是由HEK293FT细胞瞬时转染产生的,作者设计了一系列对照实验,验证了TOP-EVs传递蛋白的能力来源于直接胞内蛋白递送而不是质粒污染。作者选用多西环素 (doxycycline, Dox) 诱导的野生型GFP构建体,在Dox存在的情况下,构建体中TRE3G反式激活因子的表达可以促进GFP转基因表达。如图4B所示,作者设计了16种不同的EVs处理策略,24 h后,荧光显微镜下观察到仅GFP TOP-EVs处理的受体细胞中观察到GFP的存在,TOP-EV (+/+:配体/VSV-G) 的GFP荧光亮度最强,用Dox培养且由Dox诱导的野生型GFP质粒转染细胞产生的EVs处理的受体细胞中未检测到GFP(图4C)。这一结果验证了作者先前的假设,即TOP-EVs对胞内蛋白质递送的促进作用,并不是由于分离过程中的质粒污染或将质粒直接装载到EVs中导致的。
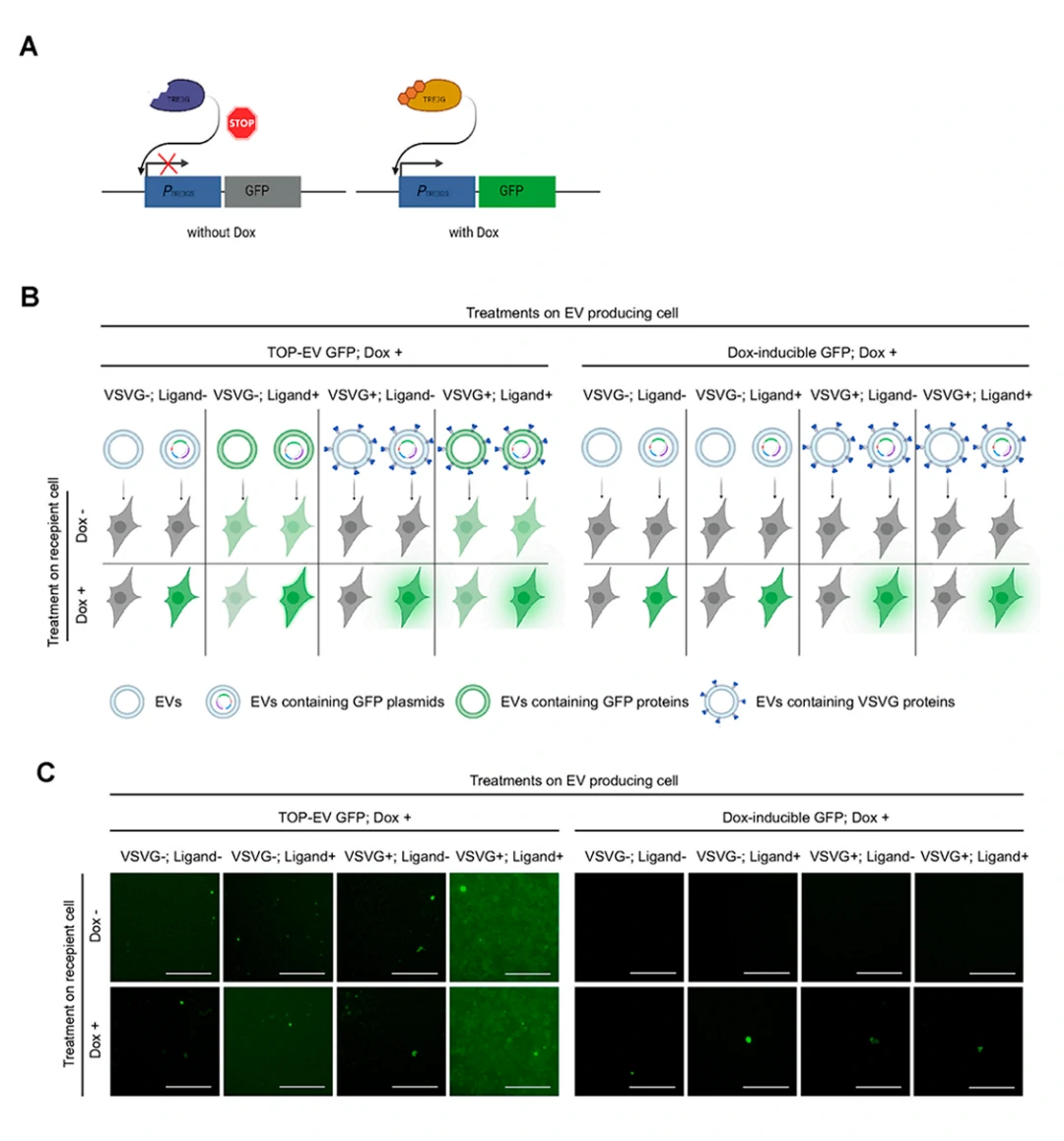
图4. 细胞水平验证TOP-EVs介导的GFP蛋白传递有效性
TOP-EVs普适性研究
为了证明TOP-EVs递送平台的普适性,作者还拓展了体外条件下TOP-EVs平台对于Cre重组蛋白酶、CRISPR/Cas9核糖核蛋白复合物 (RNP) 等靶蛋白的递送能力,同时验证配体/VSV-G对TOP-EVs介导的胞内蛋白传递的重要性。此外,研究者还发现TOP-EVs可以在体内成功介导肝脏中的细胞内蛋白质递送。
综上,研究者开发了一种在体内和体外实现内源性蛋白有效装载和介导各种靶蛋白的功能性胞内递送的多功能平台,在基因编辑领域也有强大的应用潜力
NanoFCM小结
在该研究中,作者基于纳米流式检测仪卓越的散射光和荧光检测性能,结合不同的标记策略,建立了单外泌体水平不同类型蛋白 (GFP、四跨膜蛋白(CD9/63/81) )以及膜结构的标记、检测和分析方法,纳米流式检测技术在整个TOP-EVs平台的开发和验证过程中起到关键的作用。我们期待文章的作者们能够更进一步,将TOP-EVs平台拓展到更多类型的蛋白,并向产业化迈进。